-
下列说法正确的是
A. NO2和SO2作为酸性氧化物都是可形成酸雨的气体
B. 合成纤维与光导纤维都是新型无机非金属材料
C. 亚硝酸盐属于食物防腐剂,可以大量地添加于食物中
D. 雾霾与煤炭燃烧、机动车尾气、建筑扬尘、秸秆燃烧等有关
难度: 中等查看答案及解析
-
环丙基乙烯(VCP)结构如图所示
,关于该物质说法正确的是
A. 环丙基乙烯不属于烃类
B. 该物质能发生取代反应、加成反应、聚合反应
C. 环丙基乙烯与环戊二烯(
)是同分异构体
D. 环丙基乙烯中的所有碳原子都在同一平面内
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
实验操作
现象
结论
A
含HCl、BaCl2的FeCl3溶液中通入SO2
产生白色沉淀
SO2有还原性
B
用铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
C
向Fe(OH)3悬浊液中,滴加适量饱和的MgCl2溶液
红褐色沉淀部分转化为白色沉淀
Mg(OH)2溶解度小于Fe(OH)3
D
将KI和FeCl3溶液在试管中混合后,加入CCl4振荡,静置
上层溶液显紫红色,下层无色
氧化性: Fe3+>I2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径在短周期主族元素原子中最大,Y的核外电了数是W的2倍且同主族。下列说法错误的是
A. X与Z形成的化合物熔化或溶于水时均可发生电离
B. W、X、Y元素形成的盐溶于水,溶液一定呈中性
C. 最高价氧化物对应水化物的酸性: Z>Y
D. 常温下,1molZ的单质与足量的NaOH溶液反应转移电子数NA
难度: 中等查看答案及解析
-
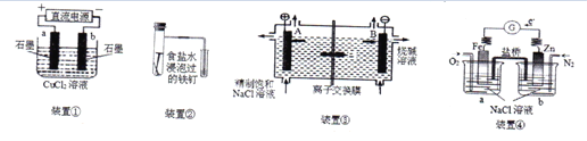
用如图所示装置进行实验,正确的是

A. 用图①装置制取并收集氨气
B. 用图②装置制取和收集纯净的Cl2
C. 用图③装置可以看到试管内液体变为红色,滴加KCl溶液后颜色加深
D. 用图④装置制取乙酸乙酯
难度: 中等查看答案及解析
-
室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是
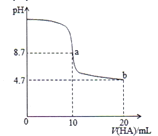
A. a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
B. a、b两点所示溶液中水的电离程度a点大于b点
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. 一元酸HA为弱酸
难度: 困难查看答案及解析


 结构片段可以简写为
结构片段可以简写为 )
)
