-
化学与生产、生活、社会密切相关,下列有关说法不正确的是
A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式
B.我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
C.日本福岛核电站爆炸时释放的2种放射性核素 的中子数不等
的中子数不等
D.食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯
-
依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是
A.卤素单质Cl2、Br2、I2的氧化性强弱
B.气态氢化物NH3、H2O、HF的稳定性
C.碱金属单质Li、Na、K与水反应的剧烈程度
D.1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,22.4 L SO3中含有O数目为3.0NA
B.常温常压下,12.2 gNaHSO4中含有离子总数为0.3NA
C.在1 L 0.1 mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
-
下列工业生产的主要反应中,涉及置换反应的是(
A.生产粗硅 B.海水提镁 C.电解冶铝 D.生产硫酸
-
下列叙述正确的是
①向久置于空气中的NaOH溶液中加盐酸时有气体产生 ②浓硫酸可用于干燥H2、NO2等气体,但不能干燥NH3、SO2等气体 ③CO2和Na2O2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2 ④足量硫单质与64 g铜反应,有2 mol电子发生转移 ⑤蔗糖炭化的演示实验中,浓硫酸既体现了强氧化性又体现了脱水性⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质
A.①④⑤ B.①⑤⑥ C.②③④ D.④⑤⑥
-
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是
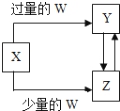
| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | Cl2 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | NaOH溶液 | AlCl3溶液 |
-
下图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是
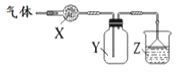
| X | Y | Z |
| A | 无水硫酸铜 | 氯气 | 饱和食盐水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
-
固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种。为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如下:
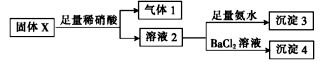
根据上述实验,下列说法正确的是
A.气体1可能为SO2和CO2的混合物
B.沉淀3可能为Mg(OH)2和Al(OH)3的混合物
C.沉淀4可能为BaCO3、BaSO3或二者混合物
D.固体粉末X中一定有Na2CO3,可能有KAlO2
-
短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14。下列叙述正确的是
A.同周期元素中W的最高价氧化物对应水化物的酸性最强
B.氢化物的热稳定性:HnY>HnW
C.Y和X、Z和X组成的常见化合物中化学键的类型相同
D.原子半径的大小顺序: rW>rZ>rY>rX
-
科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,生成可进入大气循环的气体,从而实现预期目的。下列判断错误的是
A.处理过程中,pH减小
B.废水处理中,亚硝酸盐被还原
C.废水处理时铝单质转化为AlO2-
D.铝粉颗粒大小影响废水处理的速率
-
某硫酸厂废气中SO2的回收利用方案如图所示.下列说法错误的是
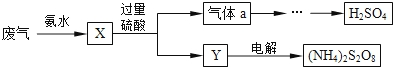
A. X可能含有2种盐
B. Y可能含有NH4HSO4
C. a是SO3
D.(NH4)2 S2O8中S的化合价不可能为+7
-
某ⅡA族元素是该族元素中在自然界最广泛存在的元素,常以化合物F的形式存在,其单质A可发生一系列如图所示的化学反应。下列说法正确的是

A.D与H溶液反应后所得溶液的溶质成分有三种可能
B.电解F与盐酸反应后的溶液以制取单质A
C.反应①、③中消耗相同H2O时反应转移电子数相同
D.工业上常用F的悬浊液与Cl2反应制取漂白粉
-
一定条件下,通过下列反应可实现燃煤烟气中硫的回收,其中Y是单质。 SO2(g) + 2CO(g) 2X(g)+Y(l),为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
2X(g)+Y(l),为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
| c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
下列说法不正确的是
A.X的化学式为CO2
B.前1s内v(X)= 1.00 mol·L-1·s-1
C.该回收原理运用了SO2的还原性
D.该温度下,此反应的平衡常数的数值是3.33×1036
-
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42﹣、NO3﹣、Cl﹣中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是
A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.该溶液中所含的离子是:Fe2+、Na+、SO42﹣、NO3﹣
D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
-
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是
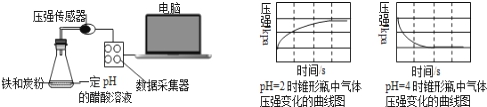
A. 溶液pH≤2时,生铁发生析氢腐蚀
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 析氢腐蚀和吸氧腐蚀的速率一样快
D. 两溶液中负极反应均为:Fe﹣2e﹣=Fe2+
-
已知下表数据:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
对于含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液,下列说法正确的是
A.向该混合溶液中逐滴加入NaOH溶液,最先看到的是红褐色沉淀
B.该溶液中c(SO42﹣):[c(Cu2+)+c(Fe2+)+c(Fe3+)]==5:4
C.向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液
D.向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物
 的中子数不等
的中子数不等






