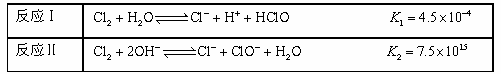-
(12分)氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式: ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:
2H2O2(l) === 2H2O(l)+O2(g) ΔH1 =-196.46 kJ·mol-1
H2(g)+ O2(g) === H2O(l) ΔH2 =-285.84 kJ·mol-1
O2(g) === H2O(l) ΔH2 =-285.84 kJ·mol-1
Cl2(g)+H2(g) === 2HCl(g) ΔH3 =-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
-
(共12分)氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:2H2O2(l)=2H2O(l)+O2(g) ΔH1 = -196.46 kJ·mol-1
H2(g)+1/2O2(g)= H2O(l) ΔH2 = -285.84 kJ·mol-1
Cl2(g)+H2(g)=2HCl(g) ΔH3 = -184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
-
氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:
2H2O2(l)  2H2O(l)+O2(g) ΔH1 =-196.46 kJ·mol-1
2H2O(l)+O2(g) ΔH1 =-196.46 kJ·mol-1
H2(g)+1/2O2(g)  H2O(l) ΔH2 =-285.84 kJ·mol-1
H2O(l) ΔH2 =-285.84 kJ·mol-1
Cl2(g)+H2(g)  2HCl(g) ΔH3 =-184.60 kJ·mol-1
2HCl(g) ΔH3 =-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
-
(16分)氯元素是生产生活中常见的非金属元素
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式: 。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
① NaCl和Cl2中化学键的类型分别是 和 。
② 燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③ 已知:
2H2O2(l) === 2H2O(l)+O2(g) ΔH1=-196.46 kJ·mol-1
H2(g)+1/2O2(g) === H2O(l) ΔH2=-285.84 kJ·mol-1
Cl2(g)+H2(g) === 2HCl(g) ΔH3=-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
(4)工业上通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
完成Ⅰ中电解过程中阳极的反应式: 。
(5)一定条件下,在水溶液中1 mol Cl-、ClO-x(x=1,2,3,4)的能量(kJ)相对大小如下图所示。

①D是 (填离子符号)。
②B A+C反应的热化学方程式为 (用离子符号表示)。
A+C反应的热化学方程式为 (用离子符号表示)。
-
氯元素是生产生活中常见的非金属元素
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式: 。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a. 臭氧 b.NH3 c. 明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
① NaCl和Cl2中化学键的类型分别是 和 。
② 燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③ 已知:2H2O2(l) === 2H2O(l)+O2(g) ΔH1=-196.46 kJ·mol-1
H2(g)+1/2O2(g) === H2O(l) ΔH2=-285.84 kJ·mol-1
Cl2(g)+H2(g) === 2HCl(g) ΔH3=-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
(4)工业上通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
完成Ⅰ中电解过程中阳极的反应式: 。
-
工业上把Cl2通入冷NaOH溶液中制得漂白液(有效成分为NaClO)。某化学小组在一定温度下将氯气缓缓通入NaOH溶液中,模拟实验得到ClO-、ClO3-等离子的物质的量n(mol)与反应时间t(min)的关系曲线。下列说法错误的是
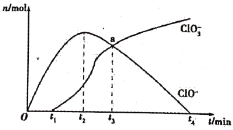
A.参加反应所需NaOH与氯气的物质的量之比一定为2:1
B.a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1
C.t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-=2Cl-+ClO3-
D.使用漂白液时,为了增强漂白效果,可以向漂白液中通入二氧化硫
-
Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解NaCl溶液生成氯气的化学方程式为 。
(2)Cl2溶于H2O、NaOH溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl2与H2O、NaOH的反应如下:
| 反应Ⅰ | Cl2+H2O Cl-+H++HClO K1=4.5×10-4 Cl-+H++HClO K1=4.5×10-4 |
| 反应Ⅱ | Cl2+2OH- Cl-+ClO-+ H2O K2=7.5×1015 Cl-+ClO-+ H2O K2=7.5×1015 |
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO发生的电极反应式是 。
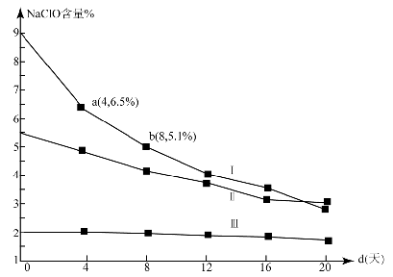
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如图所示:
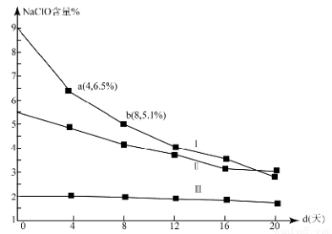
①分解速率v(Ⅰ) v(Ⅱ)(填“>”“<”或“=”),原因是 。
②NaClO分解的化学方程式是 。
③4d-8d,Ⅰ中v(NaClO)= mol/(L·d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
-
(14分)
Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒.
(1)电解NaCl溶液生成Cl2的化学方程式是 。
(2)Cl 2溶于H2O、NaOH溶液即获得氯水、漂白液.
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl 2与H2O、NaOH的反应如下:
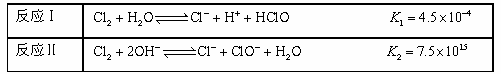
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为: 发生的电极反应式是 。
发生的电极反应式是 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下:
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是 ,原因是 。
②NaClO分解的化学方程式是 。
③ (常温下漂白液的密度约为1g / cm3,且变化忽略不计)
(常温下漂白液的密度约为1g / cm3,且变化忽略不计)
-
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO等离子其物质的量(mol)与反应时间t(min)的关系曲线。下列说法错误的是

A.工业制取漂白液的化学反应方程式为Cl2+2NaOH===NaCl+NaClO+H2O
B.a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C.t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D.使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
-
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子的物质的量(mol)与反应时间t(min)的关系曲线。下列说法不正确的是
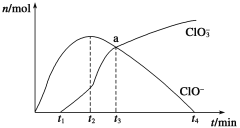
A. 工业制取漂白液的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O
B. a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D. 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
NaClO3溶液
KClO3晶体
 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体