-
下列各组离子在指定条件下,能大量共存的是( )
①在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
②使pH试纸变深蓝的溶液中:K+、CO32-、Na+、AlO2-
③水电离的c(H+)=10-13mol/L的溶液中:ClO-、CO32-、NO3-、NH4+、SO32-
④在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
⑤使甲基橙变红的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
⑥能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-.
A.①③
B.②⑤
C.①②⑤
D.③⑥难度: 中等查看答案及解析
-
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3; ②还原性:Cl->As; ③每生成1molAs,反应中转移电子的物质的量为3mol; ④M为OH-;⑤SnCl62-是氧化产物.
A.①③⑤
B.①②④⑤
C.①②③④
D.只有①③难度: 中等查看答案及解析
-
下列物质与常用危险化学品的类别不对应的是( )
A.H2SO4、NaOH--腐蚀品
B.CH4、C2H4--易燃液体
C.CaC2、Na--遇湿易燃物品
D.KMnO4、K2CrO7--氧化剂难度: 中等查看答案及解析
-
下列实验操作与安全事故处理错误的是( )
A.银镜反应实验后附有银的试管,可用稀HNO3清洗
B.不慎将酸液溅到眼中,应立即用水冲洗,边洗边眨眼睛
C.实验时手指不小心沾上苯酚,立即用70°以上的热水清洗
D.把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中难度: 中等查看答案及解析
-
用NA表示阿佛加德罗常数,下列说法中正确的是( )
A.Na2O2与H2O反应生成2.24LO2,反应中转移的电子数为0.2NA
B.4.5gSiO2晶体中含有的硅氧键数目为0.3NA
C.标准状况下,11.2L的SO3所含分子数为0.5NA
D.18g重水(D2O)所含的电子数为10NA难度: 中等查看答案及解析
-
下列实验操作中,错误的是( )
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加适量的水搅拌溶解
B.实验室里需用490mL0.1mol/L硫酸铜溶液,须称取12.5g胆矾配成500mL溶液
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2~3次
D.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释难度: 中等查看答案及解析
-
下列判断正确的是( )
A.酸性氧化物一定是非金属氧化物
B.只含有一种元素的物质,一定是纯净物
C.碱性氧化物一定是金属氧化物
D.硫酸、纯碱、石膏分属于酸、碱、盐类物质难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列与含氯化合物有关的说法正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.含有a mol FeBr2的溶液中,通入a mol Cl2:2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
B.向次氯酸钙溶液通入少量SO2:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
C.向氢氧化钙溶液中滴入少量的碳酸氢钠溶液:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
D.向盐酸中滴加氨水:H++OH-=H2O难度: 中等查看答案及解析
-
在下列各溶液中,离子或分子一定能大量共存的是( )
A.甲基橙呈黄色的溶液中:K+、Al3+、Cl-、SO42-
B.含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.使石蕊呈变红的溶液中:Na+、Fe3+、NO3-、SO42-
D.室温下,pH=1的溶液中:K+、Cr2O72-、CH3CHO、SO42-难度: 中等查看答案及解析
-
在100mL含等物质的量的HBr和H2SO3的溶液里通入0.015molCl2,若Br-全部转变Br2(已知Br2能氧化H2SO3 ).原溶液中HBr和H2SO3的浓度都等于( )
A.0.1mol/L
B.0.15mol/L
C.0.3mol/L
D.0.03mol/L难度: 中等查看答案及解析
-
下列几种溶液中的指定离子,①NaHCO3溶液中的HCO3、②Na2SO3溶液中的SO32-,③NaHCO3和Na2CO3混合溶液中的CO32-、④CH3COONa溶液中的CH3COO-,⑤饱和氢氧化钙溶液中的Ca2+,向其中加入足量的过氧化钠固体后,忽略溶液体积变化,恢复到原温度,离子浓度基本保持不变的是( )
A.②和③
B.③和④
C.④和⑤
D.①和③难度: 中等查看答案及解析
-
向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入 2mol/L的NaOH 溶液,
所生成沉淀W g 与加入 NaOH 溶液的体积V mL如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为( )
A.1:3:1
B.1:2:1
C.1:1:1
D.1:1:2难度: 中等查看答案及解析
-
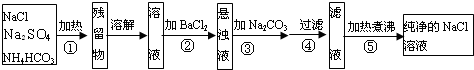
两种盐的固体混合物:①加热时有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸.满足上述条件的混合物是( )
A.BaC12和(NH4)2SO4
B.AgNO3和NH4C1
C.FeC13和NaHCO3
D.KC1和Na2CO3难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.NO2通入FeSO4溶液中溶液颜色无变化
B.氨具有还原性
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色难度: 中等查看答案及解析
-
在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为:4:2:1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为:1:3:9,则投入的铁粉与原溶液中Cu2+的物质的量之比为( )
A.5:4
B.4:5
C.3:5
D.5:6难度: 中等查看答案及解析