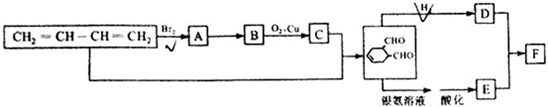
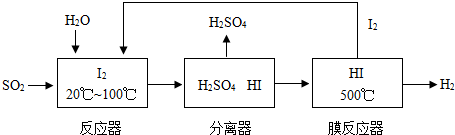
-
甲、乙、丙、丁四种易学溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成,已知:
①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/l乙溶液中c(H+)>0.1mol/l;
③向丙容器中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成.
下列结论不正确的是( )
A.甲溶液含有Ba2+
B.乙溶液含有SO42-
C.丙溶液含有Cl-
D.丁溶液含有Mg2+难度: 中等查看答案及解析
-
下列推论正确的( )
A.SiH4的沸点高于CH4,可推测pH3的沸点高于NH3
B.NH4+为正四面体,可推测出PH4+也为正四面体结构
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子难度: 中等查看答案及解析
-
下列说法正确的是( )
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.分子中含两个氢原子的酸一定是二元酸
C.含有金属离子的晶体一定是离子晶体
D.元素的非金属性越强,其单质的活泼性一定越强难度: 中等查看答案及解析
-
25℃在等体积的①pH=0的H2SO4溶液,②0.05mol•L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1:10:1010:109
B.1:5:5×109:5×109
C.1:20:1010:109
D.1:10:104:109难度: 中等查看答案及解析
-
下列“化学与生活”的说法不正确的是( )
A.硫酸钡可用钡餐透视
B.盐卤可用于制豆腐
C.明矾可用于水的消毒,杀菌
D.醋可用于除去暖水瓶中的水垢难度: 中等查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是( )
操作和现象 结论 A 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 HNO3分解成了NO2 B 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 淀粉没有水解成葡萄糖 C 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去 使溶液褪色的气体是乙烯 D 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 析出了NaHCO3
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
25℃和101kpa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75%难度: 中等查看答案及解析
-
可逆反应①X(g)+2Y(g)⇌2Z(g)、②2M(g)⇌N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图所示:下列判断正确的是( )
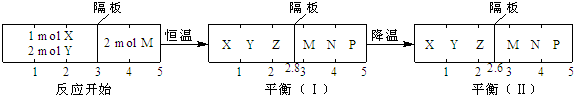
A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(I)时,X的转化率为
D.在平衡(I)和平衡(II)中,M的体积分数相等难度: 中等查看答案及解析
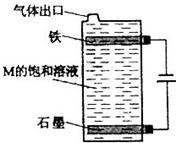
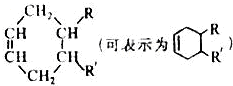 其中,R、R’表示原子或原子团.
其中,R、R’表示原子或原子团.