-
下列关于反应与能量的说法正确的是
A. Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) △H=-216kJ/mol,E反应物< E生成物
B. CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.2kJ·mol-1,E反应物< E生成物
C. HCl(g)=1/2H2(g)+1/2Cl2(s) ΔH=+92.3 kJ·mol-1,1 mol HCl在密闭容器中分解达平衡后放出92.3 kJ的能量
D. 将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) △H=-38.6kJ/mol
难度: 中等查看答案及解析
-
标准状况下,气态分子断开1mol 化学键的焓变称为键焓。已知H-H、H-O和O=O键的键焓△H分别为436kJ/mol,463kJ/mol,495kJ/mol,下列热化学方程式正确的是
A. H2O(g)=H2(g)+1/2O2(g) △H =-485kJ/mol
B. H2O(g)=H2(g)+1/2O2(g) △H =+485kJ/mol
C. 2H2(g)+O2(g)=2H2O(g) △H =+485kJ/mol
D. 2H2(g)+O2(g)=2H2O(g) △H =-485kJ/mol
难度: 简单查看答案及解析
-
500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),若液体体积变化忽略不计,下列说法正确的是
A. 原混合溶液中n(K+)为2 mol B. 上述电解过程中共转移4 mol电子
C. 电解得到的Cu的物质的量为0.5 mol D. 电解后溶液中c(H+)为2 mol/L
难度: 中等查看答案及解析
-
某原电池装置如下图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂。下列叙述正确的是
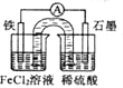
A.原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大
B.此电池工作原理与硅太阳能电池工作原理相同
C.Fe为正极,石墨上发生的反应为:2H++2e-=H2↑
D.若装置中的盐桥用铁丝代替,电流表指针有偏转
难度: 中等查看答案及解析
-
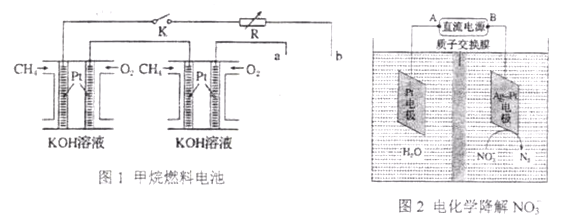
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是

A. 反应CH4+H2O
3H2+CO,每消耗1molCH4转移12mol电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 氯化铵溶于水体系温度降低,这个变化是吸热反应
B. 甲烷可用作燃料,说明甲烷燃烧是放热反应
C. 生成物总能量一定低于反应物总能量
D. 同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同
难度: 中等查看答案及解析
-
下列物质间的反应,其能量变化符合下图的是( )

A. 由Zn和稀H2SO4制氢气
B. 灼热的炭粉与二氧化碳反应
C. Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D. 碳酸钙的分解
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是
A. 2SO2+O2
 2SO3 ΔH=-196.6KJ/mol
2SO3 ΔH=-196.6KJ/molB. H2(g)+1/2O2(g)=H2O(1) ΔH=-285.8KJ/mol
C. 2H2(g)+O2(g)=2H2O(1) ΔH=-571.6KJ
D. C(s)+O2(g)=CO2(g) ΔH=+393.5KJ/mol
难度: 中等查看答案及解析
-
某实验小组学生用50mL0.50mol/L 的盐酸与50mL 0.55mol/L 的NaOH溶液在如右下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是
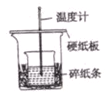
A. 如右图条件下实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若改用60 mL 0.55 mol/L盐酸与40 mL 0.50 mol/L的NaOH溶液进行反应,从理论上说所求放出热量相等
难度: 简单查看答案及解析
-
已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
难度: 简单查看答案及解析
-
如图是锌、铜和稀硫酸形成的原电池,下列叙述不合理的是
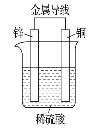
A.溶液中H+向Zn电极移动
B.外电路中电流方向为:Cu→Zn
C.负极上的电极反应:Zn-2e-===Zn2+
D.有1 mol电子流过导线,则Cu电极上产生的H2为11.2 L(标准状况)
难度: 简单查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是
A.在酸性环境下,钢铁只能发生析氢腐蚀
B.金属腐蚀的实质是金属失去电子被还原的过程
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法
D.铜铁交接处,在潮湿的空气中直接发生反应:Fe-3e-===Fe3+,继而形成铁锈
难度: 中等查看答案及解析
-
下列热化学方程式中,ΔH能正确表示物质的燃烧热的是
A. CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
B. C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
D. 2C8H18(l)+25O2(g)=16CO2(g)+18 H2O(l) ΔH=-11036 kJ·mol-1
难度: 中等查看答案及解析
-
下列各组热化学方程式的ΔH前者大于后者的是
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+
O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca (OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③
难度: 中等查看答案及解析
-
将5.4g Al投入200.0mL 2.0mol/L 的溶液中有氢气产生,成充分反应后有金属剩余。该溶液可能为
A. HNO3溶液 B. Ba(OH)2溶液 C. HCl溶液 D. H2SO4溶液
难度: 简单查看答案及解析
-
下列装置所示的实验,能达到实验目的的是

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
原电池电极的“正”与“负”不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
A. 由Fe、Cu和FeCl3溶液组成原电池,负极反应式为:Cu-2e-=Cu2+
B. 由Al、Cu和稀硫酸组成原电池中,负极反应式为:Cu-2e-=Cu2+
C. 由Mg、Al和NaOH溶液组成原电池中,负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
D. 由Al、Cu和浓硝酸组成原电池中,负极反应式为:Al-3e-=Al3+
难度: 中等查看答案及解析
-
下列有关电化学的示意图中正确的是
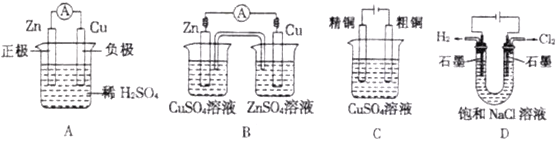
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关电解硫酸钾溶液的叙述正确的是
A. SO42-向阳极移动,K+向阴极移动,分别在两极放电
B. OH-向阳极移动,阳极附近的溶液呈碱性
C. 阴极上H+放电,阴极附近的溶液呈碱性
D. 随着电解的进行,溶液的pH减小
难度: 简单查看答案及解析
-
把SO2通入Fe(NO3)3溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是( )
A.SO2 B.NO3- C.Fe3+ D.Fe2+
难度: 中等查看答案及解析
-
氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1molN2有6mol电子转移
难度: 中等查看答案及解析
-
已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1) ΔH=-571.6kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H=-2220kJ•mol-1
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为
A. 2:3 B. 1:3 C. 3:2 D. 3:1
难度: 简单查看答案及解析
-
在298K、101kPa时,已知:2H2O(g)=O2(g)+2H2(g) △H1
Cl2(g)+H2(g)=2HCl(g) △H2;
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是( )
A. △H3=△H1+2△H2 B. △H3=△H1+△H2
C. △H3=△H1—2△H2 D. △H3=△H1—△H2
难度: 中等查看答案及解析
-
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2 mol Fe(OH)3沉淀。此过程中共消耗水 ( )
A.3 mol B.4 mol C.5 mol D.6 mol
难度: 中等查看答案及解析
-
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是
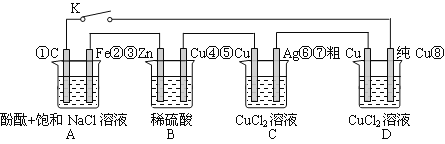
A.当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH变大,C、D装置中pH不变
难度: 中等查看答案及解析