-
分类是学习和研究化学的一种常用的科学方法.下列分类合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应( )
A.②③
B.②⑤
C.①②④
D.②③④⑤难度: 中等查看答案及解析
-
下列关于溶液和胶体的叙述,正确的是( )
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有难度: 中等查看答案及解析
-
含有分子数为b的某气体质量为a g,则V L标况下的该气体的质量为(式中NA为阿伏伽德罗常数)( )
A.g
B.g
C.g
D.g
难度: 中等查看答案及解析
-
在标况下,将V L A气体(摩尔质量M g/mol)溶于1L水中,所得A的水溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
D.1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32-难度: 中等查看答案及解析
-
在标准状况下,m g A气体与n g B气体分子数相等,下列说法不正确的是( )
A.标准状况下,同体积的气体A和气体B的质量比m:n
B.25℃时,1kg气体A与1kg气体B的分子数之比为n:m
C.同温同压下,气体A与气体B的密度之比为m:n
D.标准状况下,等质量的A与B的体积比为m:n难度: 中等查看答案及解析
-
在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入 1.92g铜粉,微热,充分反应后溶液中c(Cu2+)为( )
A.0.15mol/L
B.0.3mol/L
C.0.225mol/L
D.无法计算难度: 中等查看答案及解析
-
将某些化学知识用数轴表示,可以收到直观、简明、易记的效果.用数轴表示的下列知识正确的是( )
A.硫及其化合物的化合价与氧化还原反应的关系:
B.分散系的分类: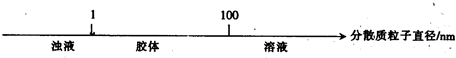
C.AlCl3溶液与NaOH溶液反应后铝元素的存在形式: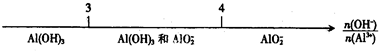
D.CO2与NaOH溶液反应后的产物
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-═Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+难度: 中等查看答案及解析
-
在某稀硝酸的溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为( )
A.1:1
B.2:1
C.3:2
D.4:1难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中大量共存的是
①无色溶液中:Cl-,Na+,H2PO4-,PO43-,SO42-
②含有HCO3-的溶液中:SO42-,Na+,NO3-,MnO4-,CO32-
③水电离的H+浓度为1×10-13mol•L-1的溶液中:Cl-,HCO3-,NO3-,NH4+,S2O32-
④加入Al能放出H2的溶液中:Mg2+,NH4+,C1-,K+,SO42-
⑤使甲基橙变红的溶液中:Fe3+,MnO4-,NO3-,Na+,SO42-
⑥在AlCl3溶液中:Fe3+,NO3-、I-,Cl-,SO42-( )
A.①②⑤
B.①③⑥
C.②④⑤
D.①②④难度: 中等查看答案及解析
-
两硫酸溶液等质量混合所得溶液质量分数为a,等体积混合所得溶液质量分数为b.另有两氨水溶液等质量混合所得溶液质量分数为a,等体积混合所得溶液质量分数为c,则关系为( )
A.a>b>c
B.b>a>c
C.c>a>b
D.b>c>a[难度: 中等查看答案及解析
-
下表中物质的分类组合完全正确的是( )
编号 A B C D 强电解质 Ba(OH)2 盐酸 HClO4 BaSO4 弱电解质 HI CaCO3 HClO NH3•H2O 非电解质 SO2 NH3 Cl2 乙醇
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列实验能达到预期目的是
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;
②用饱和NaCl溶液除去Cl2中的少量HCl;
③用饱和NaHCO3溶液除去CO2中的少量SO2;
④用加热的方法提取NH4Cl固体中混有的少量碘;
⑤用醋和澄清石灰水验证蛋壳中含有碳酸盐
⑥用米汤检验食用加碘盐中含碘;
⑦用纯碱溶液洗涤餐具;
⑧用玻璃棒搅拌漏斗中的液体以加快过滤的速度;
⑨加入盐酸以除去硫酸钠中的少量碳酸钠杂质( )
A.①④⑤⑨
B.②③⑤⑦
C.②③⑤⑧
D.②③⑤⑥⑦难度: 中等查看答案及解析
-
在t℃时,将a gNH3完全溶解于水,得V mL饱和溶液,测得该溶液的密度为ρg/cm3,质量分数为ω,其中n(NH4+) 为b mol.则下列叙述中错误的是( )
A.溶液中mol/L
B.溶质的物质的量浓度mol/L
C.溶质的质量分数:
D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω难度: 中等查看答案及解析
-
下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是
( )发生装置的药品 干燥和集气装置 A 氧化钙和浓氨水 图1 B 大理石和稀盐酸 图1 C 铜和稀硝酸 图2 D 电石和水 图2 
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH.下列有关说法正确的是( )
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等
D.此法储氢和钢瓶储氢的原理相同难度: 中等查看答案及解析
-
科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类化合物.下列说法不正确的是( )

A.维生素C具有还原性
B.上述过程中砷元素发生还原反应
C.上述过程中+5价砷类物质作氧化剂
D.+5价砷转化为+3价砷时,失去电子难度: 中等查看答案及解析