-
硅是带来人类文明的重要元素之一,下列物质中主要成分是硅酸盐的是( )
A. 大理石 B. 金刚石 C. 水晶 D. 陶瓷
难度: 简单查看答案及解析
-
下列有关物质用途的说法中,不正确的是( )
A. SO2可用于漂白纸浆 B. SiO2是良好的半导体材料
C. 硅单质可用来制造太阳能电池 D. Cl2可用于消毒和制造漂白粉
难度: 简单查看答案及解析
-
从经济效益和环境保护的角度考虑,大量制取硝酸铜最宜采用的方法是
A. Cu + HNO3(浓)→ Cu(NO3)2
B. Cu + HNO3(稀)→ Cu(NO3)2
C. Cu →CuO →Cu(NO3)2
D. Cu + AgNO3 →Cu(NO3)2
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. 氯化钠中混有少量单质碘杂质,可用升华的方法提纯
B. 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C. SO2可使酸性高锰酸钾溶液褪色,体现了SO2的漂白性
D. 浓硫酸具有吸水性,可以用作干燥剂,例如可用于NH3的干燥
难度: 中等查看答案及解析
-
下列解释事实的离子方程式不正确的是( )
A. 将稀盐酸滴入Na2SiO3溶液中,有白色胶状物: SiO32-+2H+=H2SiO3(胶体)
B. 将FeCl3溶液滴在淀粉碘化钾试纸上,试纸变蓝:2Fe3++2I-=2Fe2++I2
C. 将小块铁片溶于过量稀硝酸,溶液变黄:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D. 将铝片置于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
难度: 中等查看答案及解析
-
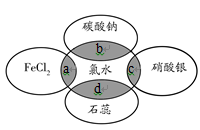
下列有关化学反应过程或实验现象的叙述中,正确的是( )
A. 氯气的水溶液可以导电,说明氯气是电解质
B. 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
C. 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
D. 氯水中加入有色布条,布条褪色,说明溶液中有Cl2存在
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
①原电池是把化学能转化成电能的一种装置
②原电池的正极发生氧化反应,负极发生还原反应
③不能自发进行的氧化还原反应,通过原电池的装置均可实现
④碳棒不能用来作原电池的正极
⑤反应Cu+2Ag+===2Ag+Cu2+,能以原电池的形式来实现
A.①⑤ B.①④⑤ C.②③④ D.②⑤
难度: 中等查看答案及解析
-
反应A+B===2C,在反应过程中,断裂1mol A中的化学键消耗的能量为Q1 kJ,断裂1mol B中的化学键消耗的能量为Q2 kJ,形成1mol C中的化学键释放的能量为Q3 kJ;1mol A所含化学能为E1 kJ, 1mol B所含化学能E2 kJ,1molC 所含化学能E3 kJ。下列说法中一定正确的是
A.若Q1+Q2 > Q3,则反应为放热反应
B.若Q1+Q2 < Q3,则反应为放热反应
C.若E 1+E 2 >E 3,则反应为放热反应
D.若E 1+E 2 >E 3,则反应为吸热反应
难度: 困难查看答案及解析
-
一学生用如图装置研究原电池原理,下列说法错误的是( )
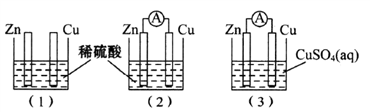
A. (1)图中铜棒上没有气体产生
B. (2)图中如果两极上都有气体产生,则说明锌片不纯
C. (2)图与(3)图中正极生成物质质量比为1:32时,锌片减轻的质量相等
D. (3)图中锌片增重质量与铜棒减轻质量的比值为65:64
难度: 中等查看答案及解析
-
某无色混合气体,依次通过浓流酸和过氧化钠,气体体积不断减少,颜色变深,则混合气体的组成是( )
A. H2O(g)、NO和N2 B. NH3、NO和CO2
C. O2、HCl和CO D. NO2、CO2和H2O(g)
难度: 中等查看答案及解析
-
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是( )
A. Fe2(SO4)3 B. KNO3 C. FeSO4 D. Na2CO3
难度: 中等查看答案及解析
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
A.KClO3在反应中失去电子 B.ClO2是氧化剂
C.H2C2O4在反应中被氧化 D.1 mol KClO3参加反应有2 mol电子转移
难度: 中等查看答案及解析
-
下列括号内为杂质,选项中除杂质的方法正确的是
A. Cu (CuO) 加入稀硝酸溶液,然后过滤洗涤干燥
B. CO2 ( SO2 ) 通过饱和Na2 CO3 溶液
C. CO2 (O2 ) 通过灼热的铜网
D. NO2 (NO) 通过水洗
难度: 中等查看答案及解析
-
按下图装置进行实验,若
轴表示流入正极的电子的物质的量,则y轴可以表示( )
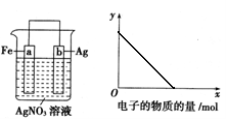
①c(Ag+) ②c(NO3-)③a棒的质量 ④b棒的质量 ⑤溶液的质量
A.①③ B.②④ C.①③⑤ D.②④⑥
难度: 中等查看答案及解析
-
将Cl2通入200mL0.5mol·L-1氢氧化钾溶液中,二者恰好完全反应得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1︰2,则通入的Cl2在标准状况下的体积为
A. 0.56L B. 1.68L C. 2.24L D. 1.12L
难度: 困难查看答案及解析