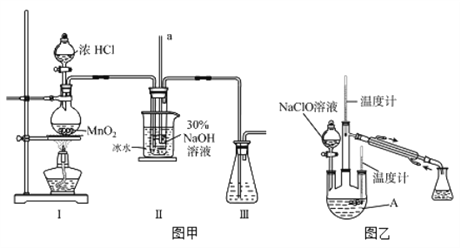
-
下列叙述错误的是( )
A. 化学反应能够制造出新的物质,但不能制造出新的元素
B. 用Na2S作沉淀剂,可除去废水中的Cu2+和Hg2+
C. 玻璃钢是一种合金,广泛用于汽车车身
D. 只要符合限量,“食用色素”、“苯甲酸钠”、“亚硝酸盐”可以作为某些食品添加剂
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大。工业上以金红石(主要成分是TiO2)为原料制备金属钛的步骤:①在高温下,向金红石与W的单质的混合物中通入Z的气体单质,得到化合物甲和化学式为WX的常见可燃性气体乙;②在稀有气体环境和加热条件下,用Y的金属单质与甲反应可得钛,下列说法不正确的是
A. 非金属性:Z>X>W
B. 简单离子半径:Z>X>Y
C. W与Z形成的化合物可用于工业上的重要有机溶剂
D. ZX2具有强氧化性,可用于饮用水消毒
难度: 中等查看答案及解析
-
将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号
稀硝酸的体积/mL
剩余固体的质量/g
NO的体积/L
1
100
17.2
2.24
2
200
8.00
4.48
3
400
0
V
下列说法正确的是( )
A. 表中 V=7.84 L
B. 原混合物粉末的质量为25.6 g
C. 原混合物粉未中铁和铜的物质的量之比为2:3
D. 实验3所得溶液中硝酸的物质的量浓度为0.875 mol•L﹣1
难度: 困难查看答案及解析
-
我国研究锂硫电池获得突破,电池的总反应是16Li+S8
8Li2S ,充放电曲线如图所示,下列说法不正确的是( )

A. 充电时,电能转化为化学能
B. 放电时,锂离子向正极移动
C. 放电时,1mol Li2S6转化为Li2S4得到2mole-
D. 充电时,阳极总电极反应式是8S2- -16e- = S8
难度: 困难查看答案及解析
-
诺卜醇可用于调制木香型化妆品及皂用香精。一种制备方法如图所示,下列说法正确的是
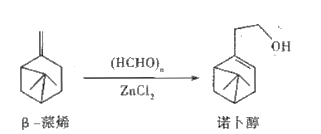
A. 可用溴的CCl4溶液区别β-蒎烯与诺卜醇
B. β-蒎烯的饱和碳原子上的一氯代物最多有7种
C. β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D. 可用乙酸检验β-蒎烯是否含有诺卜醇
难度: 中等查看答案及解析
-
在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b 呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是
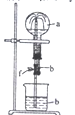
a(干燥气体)
b(液体)
①
NH3
水
②
CO2
饱和NaOH溶液
③
Cl2
饱和食盐水
④
NO2
水
⑤
HCl
0.1 mol·L−1AgNO3溶液
A. ①②③ B. ①②⑤ C. ②④⑤ D. ①②④
难度: 中等查看答案及解析
-
亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。下列说法正确的是( )

A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33- )+c(H3AsO3)= 0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
难度: 困难查看答案及解析


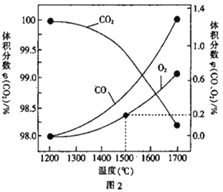




 ②丙酮能被KMnO4(H+)氧化,使之褪色
②丙酮能被KMnO4(H+)氧化,使之褪色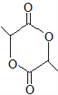 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示: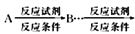 目标产物。__________________
目标产物。__________________