-
下列说法不正确的是( )
A.化学反应中一定伴随能量变化
B.甲烷燃烧是将全部的化学能转化为热能
C.物质所含化学键键能越大,其越稳定
D.大量燃烧煤炭等化石燃料是造成雾霾天气的重要原因
难度: 简单查看答案及解析
-
由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )

A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
难度: 中等查看答案及解析
-
在通常条件下,下列各组物质的性质排列正确的是( )
A. Na、Mg、Al 的第一电离能逐渐增大 B. O、 F、 N 的电负性逐渐增大
C. S2﹣、 Cl﹣、 K+的半径逐渐增大 D. 热稳定性: HF>H2O>NH3
难度: 中等查看答案及解析
-
如图装置放置一段时间后,铁钉均被腐蚀。下列有关描述不正确的是( )
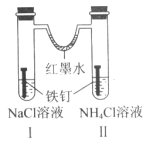
A.红墨水水柱两边的液面变为左低右高
B.I 和Ⅱ中负极反应式均为 Fe-2e-=Fe2+
C.I 中正极反应式为 O2+2H2O+4e-=4OH
D.Ⅱ中 NH4Cl 溶液里有气泡产生
难度: 中等查看答案及解析
-
向含有CaCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )
A.c(H+) B. c(Ca2+) C. c(CO32-) D. Ksp(CaCO3)
难度: 中等查看答案及解析
-
常温下,pH均为9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度为Amol・L-1和Bmol・L-1,则A与B的关系是( )
A.A=10-4B B.A>B C.B=10-4A D.A=B
难度: 中等查看答案及解析
-
下列变化不能用勒夏特列原理解释的是( )
A.向H2S水溶液中加入NaOH有利于S2-增多
B.H2、I2、HI 混合气体加压后颜色变深
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
难度: 中等查看答案及解析
-
下列图示与对应叙述相符合的是( )
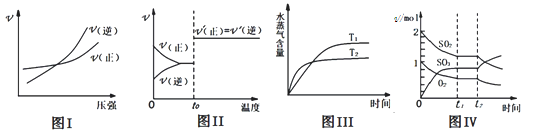
A.图 I:反应 N2(g)+3H2(g)
2NH3(g)在恒温情况下,反应速率与压强的关系
B.图Ⅱ:反应 H2(g)+I2 (g)
2HI(g)达平衡后,升高温度时反应速率随时间变化
C.图Ⅲ:反应 CO2(g)+H2(g)
CO(g)+H2O(g) ΔH>0,水蒸气含量随时间变化
D.图Ⅳ:反应 2SO2(g)+O2(g)
2SO3(g)达平衡后,缩小容器体积各成分物质的量随时间变化
难度: 困难查看答案及解析
-
一定条件下,容积为 1L 的密闭容器中发生反应: SiF4(g)+2H2O(g)
SiO2(s)+4HF(g)。下列各项中不能说明该反应已达化学平衡状态的是( )
A.v(SiF4)消耗=4v(HF)生成 B.HF 的体积分数不再变化
C.容器内气体压强不再变化 D.容器内气体总质量不再变化
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应 aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
A.A的转化率变小 B.平衡向正反应方向移动
C.D的物质的量变多 D.a>c+d
难度: 中等查看答案及解析
-
已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大。 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I3 -(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )

A.反应I2(aq)+I-(aq)
I3 -(aq)的ΔH>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
难度: 困难查看答案及解析
-
在一定温度下,将气体 X 和气体Y各0.16 mol 充入10 L恒容密闭容器中,发生反应X(g)+Y(g)
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是 ( )
A.反应前2 min 的平均速率 v(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前 v(逆)>v(正)
C.该温度下此反应的平衡常数 K=1.44
D.其他条件不变,再充入 0.2 mol Z,平衡时X的体积分数增大
难度: 困难查看答案及解析
-
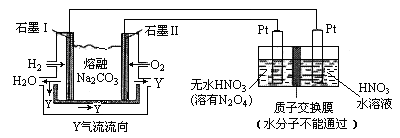
观察下列几个装置示意图,有关叙述正确的是( )
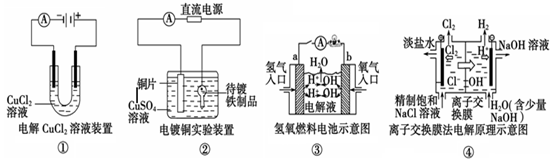
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由a极沿导线流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
难度: 困难查看答案及解析
-
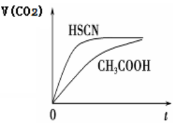
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )
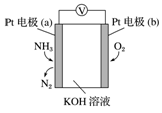
A.溶液中OH-向电极a移动
B.O2在电极b上发生还原反应
C.反应消耗的NH3与O2的物质的量之比为 4:5
D.电极 a 的反应式为 2NH3-6e-+6OH-=N2+6H2O
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.95 ℃纯水的 pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至 10 倍后 pH=4
C.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH>7
D.pH 均为3的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多
难度: 中等查看答案及解析
-
电解质溶液的电导率越大,导电能力越强。用0.100mol·L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液电导率如图所示。下列说法不正确的是( )
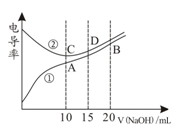
A.曲线①代表滴定CH3COOH溶液的曲线
B.在相同温度下,A、B、C 三点溶液中水电离的 c(H+):B<A=C
C.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
D.A点溶液中:c(CH3COO-)+c(OH-)-c(H+) = 0.05mol·L-1
难度: 中等查看答案及解析