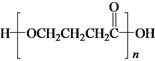-
根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焓。根据此定义,稳定单质的摩尔生成焓为0,某些化合物的摩尔生成焓如下表所示:
| 化合物 | CO2 | CH4 | CO |
| 摩尔生成焓(kJ·mol-1) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为______________________
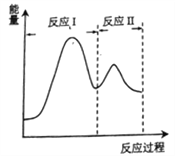
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g)  2CO(g)+2H2(g)的平衡常数表达式Kp= __________(用平衡分压p代替平衡浓度表示)
2CO(g)+2H2(g)的平衡常数表达式Kp= __________(用平衡分压p代替平衡浓度表示)
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g ), 发生反应:CO2(g)+CH4(g)  2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图所示。
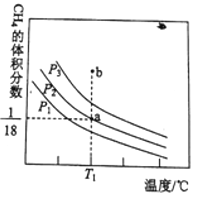
① a点时CH 4的转化率为___________________________
② 压强p 1、p 2、p 3由大到小的顺序为________________,判断理由是______________________。温度为T l℃、压强为P 3时,b点处v(正) ________v(逆)(填“<”、“>”或“="”)
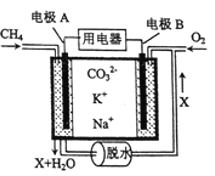
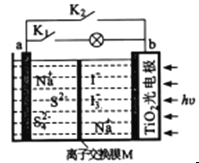
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图所示,该电池负极的电极反应式为_____________________________________________.若电极B附近通入1m 3空气(假设空气中O 2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH 4的体积为_______m3
-
聚合硫酸铁(PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为 Fe2O3 和 Fe3O4)制备 PFS,其工艺流程如下图所示。
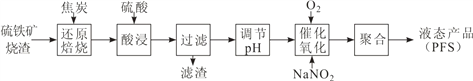
(1)CO是“还原焙烧”过程的主要还原剂。下图中,曲线表示 4 个化学反应 a、b、c、d 达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是 Fe2O3、Fe3O4、FeO、Fe 稳定存在的区域。a属于__________(填“吸热反应”或“放热反应”);570℃时,d 反应的平衡常数 K=___________________。
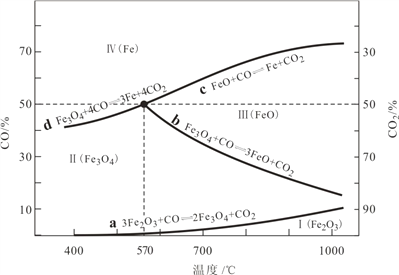
(2)800℃,混合气体中CO2的体积分数为40%时,Fe2O3用CO还原焙烧过程中发生的主要的化学反应方程式:________________________________________________
(3)若“酸浸”时间过长,浸出液 Fe2+含量反而降低,主要原因是___________________。
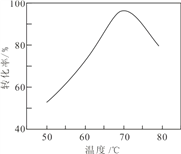
(4)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17,Ksp[Fe(OH)3]=1.0×10-39。若浸出液中c(Fe3+) = 10-1.8mol·L-1,为避免“催化氧化”过程中产生副产物 Fe(OH)3,应调节浸出液的 pH≤___________。
(5)FeSO4 溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4 ,该反应的离子方程式_____________________________________.
(6)“催化氧化”过程中,用 NaNO2 作催化剂(NO 起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+ 转化率随温度的升高先上升后下降的原因是___________________________________________.
-
碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
| 实验 | 试剂 | 现象 |
| 滴管 | 试管 |
| 
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 |
| 0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
□Fe2+ +□____+□ + □H2O=□ Fe(OH)3 +□HCO3−
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
| 操作 | 现象 |
| 实验 IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
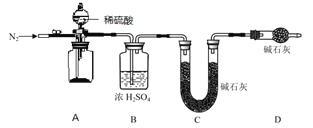
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是_______________________________________
-
有机物P是某抗病毒药物的中间体,它的一种合成路线如下。
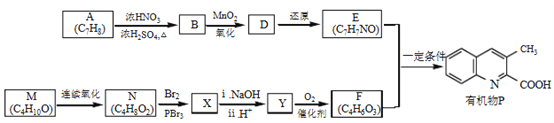
已知:

(1)A为芳香化合物,其结构简式是________________________________________
(2)A→B的化学方程式是,_____________________反应类型是_____________________________________
(3)M无支链,N中含有的官能团是_________________________________
(4)M连续氧化的步骤如下:

M转化为Q的化学方程式是________________________________。
(5)X的分子式是C4H7O2Br。下列说法正确的是(_______)
a.F能发生酯化反应和消去反应
b.Y在一定条件下可生成高分子化合物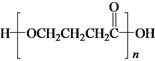
c.1 molX与NaOH溶液反应时,最多消耗2mol NaOH
(6)E的结构简式是_____________________________________
(7)以乙烯为起始原料,选用必要的无机试剂合成M,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
H2↑ + Cu2+
),拓展了人工合成自然产物的技术。下列有关该烃的说法正确的是
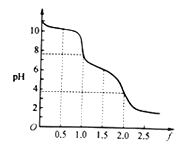
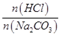 ]与混合液pH的关系如图所示。下列说法正确的是
]与混合液pH的关系如图所示。下列说法正确的是