-
下列反应的离子方程式书写正确的是( )
A. 钠和冷水反应Na+2H2O=Na++2OH-+H2↑
B. 金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑
C. 金属铝溶于盐酸中2Al+6H+=2Al3++3H2↑
D. 铁跟稀硫酸反应2Fe+6H+=2Fe3++3H2↑
难度: 中等查看答案及解析
-
在物质分类中,前者包括后者的是( )
A. 氧化物、化合物 B. 化合物、电解质
C. 溶液、 胶体 D. 溶液、 分散系
难度: 简单查看答案及解析
-
下列实验能达到目的的是
A. 将蒸发皿放置在铁架台的铁圈上的石棉网加热
B. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉
C. 用玻璃棒搅拌漏斗中的液体以加快过滤的速度
D. 加入盐酸以除去硫酸钠中的少量碳酸钠杂质
难度: 中等查看答案及解析
-
研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的应该是
A. 青菜中含有维生素C
B. 维生素C具有还原性
C. 致人中毒过程中砷发生还原反应
D. 砒霜是氧化产物
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 固体氯化钠不导电,所以氯化钠不是电解质
B. 铜丝能导电,所以铜是电解质
C. 氯化氢水溶液能导电,所以氯化氢是电解质
D. SO3 溶于水能导电,所以 SO3 是电解质
难度: 简单查看答案及解析
-
为使以面粉为原料的面包松软可口,通常用NaHCO3作发泡剂,因为它( )
①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子
A. ②③ B. ①③ C. ①④ D. ③④
难度: 中等查看答案及解析
-
下列各组物质中所含分子数一定相同的是
A. 5.6L N2和11g CO2 B. 5g CO和5g H2
C. 含1mol H原子的H2O和0.5mol Br2 D. 质子数相等的NH3和HCl
难度: 中等查看答案及解析
-
在碱性溶液中,下列各项中的离子可以大量共存的是
A. Fe3+、Cu2+ 、Cl-、NO3- B. K+、NO3-、Ag+、Cl-
C. Na+、SO42-、K+、Cl- D. Ca2+、MnO4-、Na+、CO32-
难度: 简单查看答案及解析
-
在3NO2+H2O=2HNO3+NO中,氧化剂与还原剂的分子个数比为
A. 2:1 B. 1:2 C. 3:1 D. 1:3
难度: 中等查看答案及解析
-
使用胆矾(CuSO4·5H2O)配制1L 0.2 mol·L-1的硫酸铜溶液,正确的操作是( )
A. 将胆矾加热除去结晶水后,称取32 g溶解在1 L水里
B. 称取胆矾50 g,溶解在1 L水里
C. 将32 g胆矾溶于水,然后将此溶液稀释至1 L
D. 将50 g胆矾溶于水,然后将此溶液稀释至1 L
难度: 中等查看答案及解析
-
将金属钠投入饱和MgCl2溶液中,下列现象合理的是
A.开始时,钠浮在液面上、四处游动并熔成小球
B.反应结束后,在溶液底部有银白色金属产生
C.反应结束后,在溶液中无沉淀生成
D.反应结束后,在溶液底部析出黑色固体
难度: 中等查看答案及解析
-
在①Al ②Al2O3 ③Al(OH)3 ④NaHCO3四种物质中,既能与硫酸反应又能和氢氧化钠反应的化合物是
A. ②③④ B. ①②③④ C. ①③④ D. ①②④
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42- ===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42- ===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
【答案】D
【解析】A. 氯化铁溶液中的铁离子具有氧化性,能够氧化碘离子,与碘化钾溶液反应的离子方程式为2Fe3++2I-===2Fe2++I2,故A错误;B. 硫酸溶液与氢氧化钡溶液反应生成硫酸钡沉淀和水,离子方程式为Ba2++SO
+2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH
,故D正确;故选D。
【题型】单选题
【结束】
15金属加工后的废切削液中含2%~3%的NaNO2,它是一种环境污染物,人们用NH4Cl溶液来处理废切削液,使NaNO2转化为无毒物质,该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2
第二步:NH4NO2=N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2只是氧化剂 ②NH4NO2只是还原剂
③NH4NO2发生了分解反应 ④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④ C. ②③④ D. ③④⑤
难度: 中等查看答案及解析
-
金属加工后的废切削液中含2%~3%的NaNO2,它是一种环境污染物,人们用NH4Cl溶液来处理废切削液,使NaNO2转化为无毒物质,该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2
第二步:NH4NO2=N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2只是氧化剂 ②NH4NO2只是还原剂
③NH4NO2发生了分解反应 ④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④ C. ②③④ D. ③④⑤
【答案】D
【解析】本题考查氧化还原反应的基本概念。第二步反应中NH4NO2发生了自身的氧化还原反应,其中氮元素发生了归中反应,NH4NO2既是氧化剂又是还原剂,从四大基本反应类型看,NH4NO2发生的是分解反应,所以③④⑤是正确的。故D选项符合题意。
【题型】单选题
【结束】
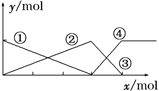
16下图表示AlCl3溶液与NaOH溶液相互滴加混合,由图中判断错误的是( )
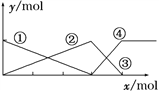
A. ①线表示Al3+物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3物质的量的变化
D. ④线表示AlO
物质的量的变化
难度: 中等查看答案及解析