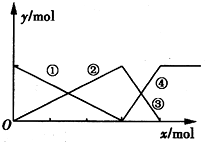
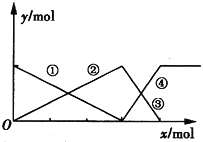
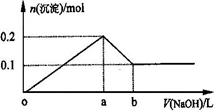
下图表示AlCl3溶液与NaOH溶液相互滴加混合,由图中判断错误的是( )
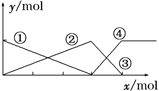
A. ①线表示Al3+物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3物质的量的变化
D. ④线表示AlO物质的量的变化
【答案】B
【解析】假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗molAl3+,生成
molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少,①线表示Al3+的物质的量的变化,选项A正确;B.由上述分析可知,x表示NaOH溶液,选项B错误;C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,后减小,故②③线表示Al(OH)3的物质的量的变化,选项C正确;D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,④线表示AlO2-的物质的量的变化,选项D正确。答案选B。
点睛:本题考查镁铝重要化合物、离子反应、化学计算等,根据相互滴加过程离子物质的量的变化确定图象表示向AlCl3溶液中滴加NaOH溶液是解题的关键。假定向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,假定向含有4molNaOH溶液中滴加AlCl3溶液,首先发生反应Al3++4OH-=AlO2-+2H2O,OH-完全反应消耗1molAl3+,生成1molAlO2-,然后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,AlO2-完全反应,消耗molAl3+,生成
molAl(OH)3↓,前后两部分消耗的Al3+为1mol:
mol=3:1,由图象可知,①②表示微粒、③④表示微粒物质的量关系为1:1可知,该图表示向AlCl3溶液中滴加NaOH溶液,据此结合选项解答。
【题型】单选题
【结束】
17
(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
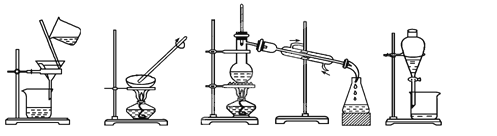
① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
| 取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
| 生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
高一化学综合题中等难度题