-
少量铁片与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L盐酸.
A. ①⑥⑦ B. ③⑤⑧ C. ③⑦⑧ D. ③④⑥⑦⑧
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色
C. 对2 HI(g)
H2(g) + I2(g)平衡体系增大压强使气体颜色变深
D. 溴水中有下列平衡Br2 + H2O
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
难度: 简单查看答案及解析
-
一定条件下,可逆反应C(s)+CO2(g)
2CO(g)△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的( )
A. ①③ B. ①②③④ C. ④② D. ①③④
难度: 困难查看答案及解析
-
在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应
A(g)+2B(g)
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤
C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
难度: 中等查看答案及解析
-
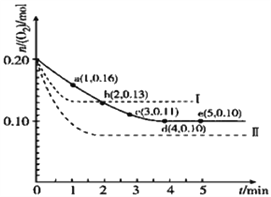
在溶液中,反应A+2B
C分别在三种不同实验条件下进行,它们的起始状态均为c(A) = 0.100 mol·L-1 c(B) = 0.200 mol·L-1 、c(C) = 0 mol·L-1 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是
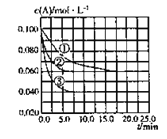
A. 反应的平衡常数:①<② B. 反应A+2B
C的△H >0
C. 实验②平衡时B的转化率为60% D. 实验③平衡时c(C) = 0.04 mol·L-1
难度: 困难查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体总物质的量增大的方向移动;
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A. ①④ B. ①②③ C. ②③④ D. ①②③④
难度: 中等查看答案及解析
-
298K时,合成氨反应的热化学方程式为:N2(g)+3H2(g)
2NH3(g);△H=﹣92.4kJ/mol,在该温度下,取1mol N2和3mol H2放在密闭容器内反应.下列说法正确的是( )
A. 在有催化剂存在的条件下,反应放出的热量为92.4 kJ
B. 有无催化剂该反应放出的热量都为92.4 kJ
C. 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ
D. 反应放出的热量始终小于92.4 kJ
难度: 中等查看答案及解析
-
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)=4NO2(g)+O2(g),△ H>0, T1温度时,向密闭容器中通入N2O5,部分实验数据见表下列说法中不正确的是
时间/s
0
500
1000
1500
c (N2O5) /rnol/L
5.00
3.52
2.50
2.50
A. 500s内用O2表示的平均速率为1.48×10-3mol/(L-s)
B. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
C. T1温度下N2O5的平衡转化率为50%
D. 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时 c(N2O5)>5.00mol/L
难度: 困难查看答案及解析
-
已知下列三种气态物质之间的反应:
C2H2(g)+H2(g)
C2H4(g)①
2CH4(g)
C2H4(g)+2H2(g)②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C(s)+2H2(g)=CH4(g) ΔH=-Q1kJ/mol
C(s)+
H2(g)=
C2H2(g) ΔH=-Q2kJ/mol
C(s)+H2(g)=
C2H4(g) ΔH=-Q3kJ/mol
Q1、Q2、Q3均为正值,下列关系正确的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
难度: 中等查看答案及解析
-
已知同温同压下,下列反应的焓变和平衡常数分别表示为
①2SO2(g)+O2(g)
2SO3(g) ΔH1=-197kJ/mol K1=a
②2NO(g)+O2(g)
2NO2(g) ΔH2=-144kJ/mol K2=b
③NO2(g)+SO2(g)
SO3(g)+NO(g) ΔH3=mkJ/mol K3=c
下列说法正确的是( )
A. m=-26.5 2c=a-b B. m=-53 c2=a/b
C. m=-26.5 c2=a/b D. m=-53 2c=a-b
难度: 中等查看答案及解析
-
已知4NH3(g)+5O2(g) =" 4NO(g)" +6H2O(l) △H=-xkJ/mol。蒸发1mol H2O(l)需要吸收的能量为44kJ,其它相关数据如下表:
NH3(g)
O2(g)
NO(g)
H2O(g)
1mol分子中的化学键断裂时需要吸收的能量/kJ
a
b
z
d
则表中z(用x、a、b、d表示)的大小为
A.(x+4a+5b-6d-44)/4 B.(x+12a+5b-12d-264)/4
C.(x+4a+5b-6d-264)/4 D.(x+12a+5b-12d-44)/4
难度: 中等查看答案及解析
-
对于平衡体系mA (g) +nB (g) ==C (g) +gD (g);△H <0,下列结论中错误的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m: n
难度: 困难查看答案及解析
-
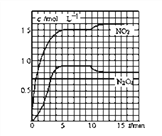
甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图所示。下列说法正确的是( )
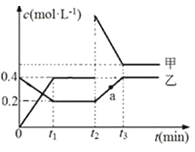
A. 甲是N2O4
B. a点处于平衡状态
C. t1~t2时间内v正(乙)<v逆(甲)
D. 反应进行到t2时刻,改变的条件可能是升高温度
难度: 困难查看答案及解析
-
下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键
C—C
C===C
C—H
H—H
键能/(kJ·mol-1)
348
610
413
436
上表数据可以计算出
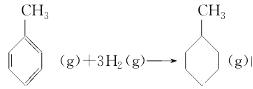 的焓变
的焓变⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
难度: 极难查看答案及解析
-
一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是
A. 平衡向正反应方向移动 B. x+y<z
C. C 的体积分数降低 D. B的转化率提高
难度: 中等查看答案及解析