-
化学与环境保护、社会可持续发展密切相关,下列做法合理的是( )
①将地沟油回收加工为生物柴油,提高资源的利用率
②进口国外电子垃圾,回收其中的贵重金属
③大量生产超薄塑料袋,方便人们的日常生活
④燃煤进行脱硫脱硝处理,减少硫的氧化物和氮的氧化物的排放
⑤洗衣粉中添加三聚磷酸钠(Na3P5O10),增强去污效果.
A.②③④⑤
B.①②③
C.①②⑤
D.①④难度: 中等查看答案及解析
-
下列过程中不涉及化学变化的是( )
A.中科院实验室用石墨制得金刚石
B.北冰洋的冰在南极解冻,由冰变为水,再变为水蒸气
C.日本“3•11”大地震用“84”消毒液杀菌消毒
D.2010广州亚运会开幕式的烟花燃放难度: 中等查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是( )
A.NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体
B.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污
C.次氯酸钠具有强还原性,可用于配制“84”消毒液
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液:Na+,NH4+、S2-、NO3-
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.滴入少量硫氰酸钾溶液显红色的溶液:Na+、K+、I-、SO42-
D.能溶解碳酸钙的溶液:Na+、NH4+、Cl-、Br-难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X Y Z W
A.X的最常见气态氢化物的水溶液显酸性
B.最高价氧化物对应水化物的酸性W比Z强
C.Z的单质与氢气反应较Y剧烈
D.X的原子半径小于Y难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式,其中正确的是( )
A.向Na[Al(OH)4]溶液中通入足量的CO2:[Al(OH)]4-+CO2=Al(OH)3↓+HCO3-
B.(NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液:2NH4++Fe2++4OH-=Fe(OH)2↓+2NH3•H2O
C.NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.用惰性电极电解NaHS溶液:S2-+2H2OS↓+H2↑+2OH-
难度: 中等查看答案及解析
-
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )

A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊
C.若A为浓硝酸,B为铜,C中盛KI-淀粉溶液,则C中溶液变蓝
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.pH=13的氢氧化钠溶液,含Na+数目为0.1NA
B.标准状况下,22.4L乙醇中含C-H键数目为5NA
C.常温下,23g NO2含有NA个氧原子
D.反应:4Mg+10HNO3(极稀)=4Mg(NO3)2+N2O↑+5H2O,每生成1molN2O,转移电子总数为10NA难度: 中等查看答案及解析
-
糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质.下列说法正确的是( )
A.蛋白质中只含C、H、O三种元素
B.油脂在人体中发生水解的产物是氨基酸
C.牛油、大豆油的主要成分都是高级脂肪酸甘油酯
D.糖类、油脂、蛋白质一定都能发生水解反应难度: 中等查看答案及解析
-
下列说法正确的是( )
A.含有金属阳离子的物质一定是离子化合物
B.由不同种原子组成的纯净物一定是化合物
C.含金属元素的离子不一定是阳离子,合金一定含有金属元素
D.碱性氧化物一定是金属氧化物,非金属氧化物一定是酸性氧化物难度: 中等查看答案及解析
-
常温下将KOH溶液与HF稀溶液混合,不可能出现的结果是( )
A.pH=7且c(F-)>c(K+)>c(H+)=c(OH-)
B.pH<7且c(F-)>c(H+)>c(K+)>c(OH-)
C.pH>7且c(K+)+c(H+)=c(F-)+c(OH-)
D.pH>7且c(K+)>c(OH-)>c(F-)>c(H+)难度: 中等查看答案及解析
-
TCL集团于2006年全面采用钛金属技术.单质钛的机械强度高,抗蚀能力强,有“未来金属”之称.工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4
③H2TiO3═TiO2+H2O
④TiO2+2C+2Cl2TiCl4+2CO
⑤TiCl4+2Mg2MgCl2+Ti
下列叙述错误的是( )
A.反应①是非氧化还原反应
B.反应②是水解反应
C.反应④中TiO2是氧化剂
D.反应⑤是置换反应难度: 中等查看答案及解析
-
已知100℃时,水的离子积常数Kw=1×l0-12,对于该温度下pH=1的硫酸,下列叙述正确的是( )
A.向该溶液中加入同温同体积pH=13的Ba(OH)2溶液,反应后溶液呈中性
B.该溶液中硫酸电离出的c(H+)与水电离出的c(H+)之比为10-10
C.等体积的该硫酸与室温下pH为1的硫酸中和碱的能力相同
D.该溶液中水电离出的c(H+)是同温下pH为3的硫酸中水电离出的c(H+)的100倍难度: 中等查看答案及解析
-
X、Y混合气体在密闭容器中发生如下反应:aX(g)+bY(g)⇌cZ(g)△H<0;达到化学平衡后,测得X气体的浓度为0.5mol/L;当恒温下将密闭器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3mol/L.则下列叙述正确的是( )
A.平衡向右移动
B.a+b>c
C.Y的转化率提高
D.Z的体积分数增加难度: 中等查看答案及解析
-
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
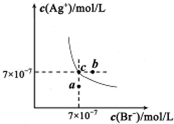
A.在t℃时,AgBr的Ksp为4.9×l0-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq)⇌AgBr(s)+Cl-(aq)平衡常数K≈816难度: 中等查看答案及解析
-
下列有关实验原理,方法和结论都正确的是( )
A.某钠盐溶液中加入硝酸无明显现象,再加入氯化钡溶液有白色沉淀,该钠盐一定是硫酸钠
B.在硫酸钡中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
C.新制氯水中加入碳酸钙粉末搅拌,过滤、滤液中c(HClO)将增大
D.相同质量的两份锌粒分别加入足量稀硫酸,在一份中加入少量CuSO4•5H2O,其反应速率将加快,且最终产生的H2与另一份相同难度: 中等查看答案及解析