-
化学与社会、生活密切相关,下列说法正确的是( )
A. 可以利用化学氧化(铬酸做氧化剂)的方法使铝制品表面的氧化膜产生美丽的颜色。
B. 将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,说明“纳米铜”的还原性比铜片更强
C. 直馏汽油、裂化汽油、植物油均能使溴的四氯化碳溶液褪色
D. 高压钠灯发出透雾性能力强的淡紫色光,常做路灯
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1mol金刚石中含有2NA个C-C键,1mol SiO2含有2NA个Si-O键
B. 标况下,将9.2g甲苯加入足量的酸性高锰酸钾溶液中转移的电子数为0.6NA
C. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
D. 标准状况下,22.4 L庚烷中所含的分子数约为NA
难度: 中等查看答案及解析
-
(题文)下列有机物说法不正确的是( )
A. BrCH2CHBrCH2Br的名称为三溴丙烷
B. 萘环上的一个H原子被-C4H9取代后的产物共有8种
C. 对甲基苯乙烯中最多有17个原子共面
D. 纤维素和淀粉都是多糖,它们彻底水解后的产物相同
难度: 中等查看答案及解析
-
工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯(柠檬烯
)。提取柠檬烯的实验操作步骤如下:
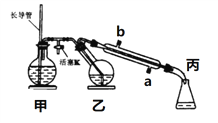
(1)将1~2个橙子皮剪成细碎的碎片,投入乙装置中,加入约30 mL水
(2)松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
下列说法不正确的是( )
A. 当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B. 蒸馏结束后,为防止倒吸,立即停止加热
C. 长玻管作安全管,平衡气压,防止由于导管堵塞引起爆炸
D. 要得到纯精油,还需要用到以下分离提纯方法:萃取、分液、蒸馏
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的元素的原子最外层电子数之和为20。则下列说法正确的是( )
X
Y
W
Z
A. 氢化物的沸点:Y<Z
B. 原子半径大小:Z>W>Y>X
C. 工业上用电解熔融的W与Y所形成的化合物来制取W
D. X的一种氢化物可以和Z的单质反应生成大量白烟
难度: 中等查看答案及解析
-
某化学兴趣小组学生对塑料饭盒废弃物的水解液进行电渗析处理,同时得到对苯二甲酸。原理如图所示(H2A表示对苯二甲酸,A2-表示对苯二甲酸根离子),下列说法正确的是( )
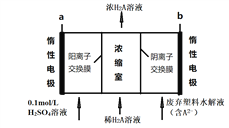
A. 电极a为阴极,电极b产生氧气
B. 通电一段时间后,硫酸溶液pH升高
C. A2-通过阴离子交换膜进入浓缩室
D. 对200ml的8.3g/L对苯二甲酸溶液,通电一段时间后,浓度上升到0.1mol/L,阴极产生气体体积4.48L
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A. 10mL0.1mol·L-1Na2CO3溶液逐滴滴加到10mL0.1mol·L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
B. NH4HCO3溶液中存在:C(NH4+)=C(HCO3-)+C(CO32-)+C(H2CO3)
C. 常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=3.6×10-10
D. 若两种盐溶液的浓度相同且pH(NaX)>pH(NaY),则c(X-)+c(OH-)<c(Y-)+c(OH-)
难度: 中等查看答案及解析



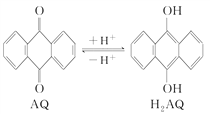

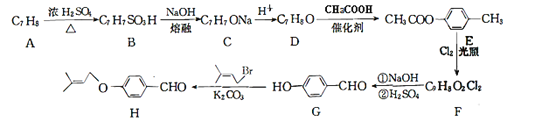
 ,参照上述合成路线,以
,参照上述合成路线,以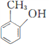 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备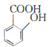 的路线__________。
的路线__________。