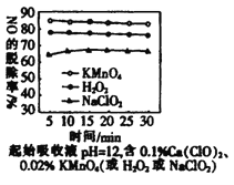
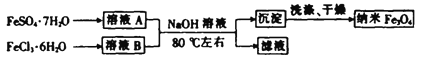
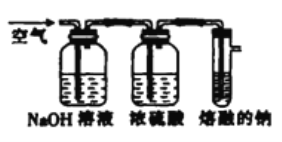
-
我国科学家屠呦呦因发现抗疟疾新药青蒿素(C15H22O5)而荣获2015年诺贝尔生理学或医学奖。青蒿素属于
A. 无机物 B. 氧化物 C. 氢化物 D. 有机物
难度: 简单查看答案及解析
-
下列与化学有关的文献记载中,理解错误的是
A. 《咏石灰》“……烈火焚烧若等闲……要留清白在人间”,其中“清白”是指碳酸钙
B. 《咏煤炭》“凿开混沌得乌金……不辞辛苦出山林”,其中“乌金”的主要成分是煤炭
C. 《天工开物》:“以消石、硫磺为主。草木灰为辅。……魂散惊而魄齑粉”,其中提到的是火药
D. 《本草纲目》:“冬月灶中所烧薪柴之灰、令人以灰淋汁,取碱浣衣”,其中的“碱”是KOH
难度: 中等查看答案及解析
-
同温同压下,下列气体的质量都相同,其中体积最大的是
A. CH4 B. HCl C. SO2 D. NH3
难度: 简单查看答案及解析
-
向小烧杯中分别加入等体积的水和煤袖,片刻后再向该烧杯中缓慢地加入绿豆大小的金属钠,可能观察到的现象是
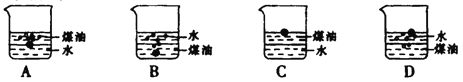
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
南京理工大学团队合成了能在室温下稳定存在的五氮阴离子盐[(N5)6(H3O)3(NH4)4Cl],已知五氮阴离子(N5-)是制备全氮类物质(N5+N5-)的重要中间体。下列说法正确的是
A. N5+N5-属于化合物
B. (N5)6(H3O)3(NH4)4Cl中含有四种离子
C. 每个N5-中含有35个电子
D. N5+N5-的摩尔质量为140
难度: 中等查看答案及解析
-
下列物质的主要成分及用途均对应正确的是
选项
A
B
C
D
物质
碳酸氢铵
漂白粉
赤铁矿
双氧水
主要成分
(NH4)2CO3
NaClO
Fe3O4
H2O2
用途
作氮肥
作消毒剂
炼铁、制磁铁
杀菌消毒
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在无色透明的强酸性溶液中,下列能大量共存的一组离子是
A. K+、Na+、NO3-、Fe2+ B. K+、NH4+、S2-、ClO-.
C. K+、Na+、Br-、Cu2+ D. Mg2+、Na+、Cl-、SO42-
难度: 简单查看答案及解析
-
氟氧酸是较新颖的氧化剂。应用性极强,可用被氮气稀释的氟气在细冰上缓慢通过制得,其反应原理如下:F2+H2O=HOF+HF。该反应与下列反应中水的作用相同的是
A. 炭与水蒸汽反应制氢气 B. 过氧化钠与水反应制氧气
C. 氟单质与水反应制氧气 D. 氯气与水反应制次氯酸
难度: 简单查看答案及解析
-
用NA 表示阿伏加德罗常数的数值,下列说法一定正确的是
A. 0.1mol.L-l的NaOH溶液中含OH-的数目为0.1 NA
B. 4.4 g N2O 和2.24 L(标准状况)H2S均含有0.1 NA 个分子
C. 78 g 金属钾(K)完全转化为超氧化钾(KO2)时,转移的电子数为4 NA
D. 含2 mol NaHSO4的溶液中,阳离子和阴离子的总数为4 NA
难度: 中等查看答案及解析
-
下列反应的离于方程式书写正确的是
A. 向沸水中滴入FeCl3饱和溶液:Fe3+ +3H2O
Fe(OH)3↓+3H+
B. 向NaOH 溶液中通入过量二氧化硫:OH-+SO2=HSO3-
C. 将一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑
D. 向Fe(NO3)3溶液中加入过量HI溶液:2Fe3++2I-=2Fe2++I2
难度: 中等查看答案及解析
-
向紫色石蕊试液中加入过量Na2O2 粉末,振荡,可观察到的现象为
A. 溶液最终变为红色 B. 溶液最终变为蓝色
C. 有气泡产生,溶液先变蓝色后变为无色 D. 有气泡产生,溶液仍为紫色
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质的转化过程均能一步实现的是
A. FeS2
SO2
H2SO4 B. Na
Na2O
NaOH
C. SiO2
SiCl4
Si D. NH3
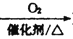 NO2
NO2HNO3
难度: 简单查看答案及解析
-
H3PO2是精细磷化工产品。工业制备原理如下:
(I)2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
(II)Ba(H2PO2)2+H2SO4=BaSO4↓+ 2H3PO2
下列推断不正确的是
A. 反应I是氧化还原反应,反应II是非氧化还原反应
B. H3PO2具有强还原性,在空气中可能被氧化成磷酸
C. 在反应I中氧化剂与还原剂的质量之比为1: 1
D. 在标准状况下生成2.24LPH3,上述反应转移0.3mol 电子
难度: 中等查看答案及解析
-
用如图所示装置进行实验,下列对实验现象的解释不合理的是
选项
①中试剂
①中现象
解释
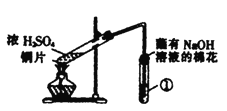
A
品红溶液
溶液褪色
SO2具有漂白性
B
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
C
酸性KMnO4溶液
紫色褪去
SO2具有还原性
D
Ba(NO3)2溶液
生成白色沉淀
SO32-与Ba2+生成白色BaSO3沉淀
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某溶液中大量存在六种离子:NO3-、SO42-、Fe3+、Mg2+、H+、X,且各离子物质的量浓度之比为3:4:1:1:2:2,则X可能为
A. Fe2+ B. Cl- C. Cu2+ D. Ba2+
难度: 中等查看答案及解析
-
向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是
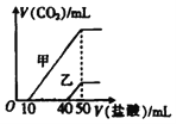
A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
难度: 困难查看答案及解析