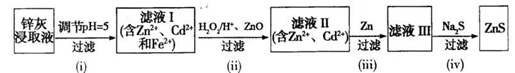
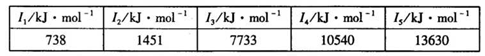
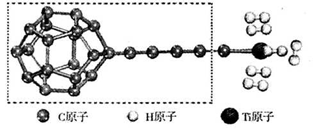
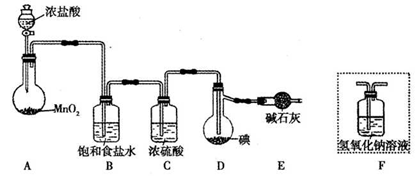
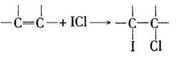-
不涉及氧化还原反应的是
A.海水提镁 B.明矶净水 C.工业固氮 D.电池充电
难度: 简单查看答案及解析
-
下列说法不正确的是
A.由石油分馏得到的汽油是纯净物
B.淀粉和纤维素均属于高分子化合物
C.苯和乙醇都能发生取代反应
D.葡萄糖经缓慢氧化可以生成二氧化碳和水
难度: 中等查看答案及解析
-
下列实验合理的是
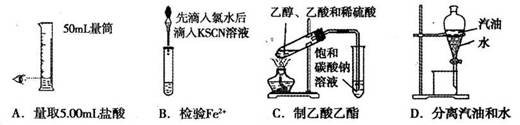
难度: 中等查看答案及解析
-
常温下,往NH4NO3溶液加人少量Na2O固体,溶液中微粒的数目不变的是
A.NH4+ B.H+ C.NO3- D.H2O
难度: 中等查看答案及解析
-
室温下,抽去下图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是(设NA表示阿伏加德罗常数的值)
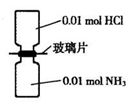
A.气体反应物的总体积为0.448L
B.装置中氢元素的总质量为0.04g
C.生成物中含有0.01NA个分子
D.生成物完全溶于永后所得溶液含有0.01 NA个NH4 +
难度: 中等查看答案及解析
-
中学化学常见物质甲、乙、丙、丁之间存在转化关系:甲+乙→丙+丁。下列说法正确的是
A.若甲为铜,丁为氯化亚铁,则乙一定是氯化铁
B.若甲为碳,丁为硅,则丙一定是二氧化碳
C.若甲为铝,丁为铁,则乙一定是氧化铁
D.若甲为镁,丁为氢气,则乙一定是酸
难度: 中等查看答案及解析
-
下图为Mg—NaClO燃料电池结构示意图。下列说法正确的是
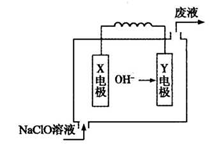
A.镁作Y电极
B.电池工作时Na+向负极移动
C.废液的pH大于NaClO溶液的pH
D.X电极上发生的反应为:ClO—+2H2O—4e—=ClO3—+4H+
难度: 中等查看答案及解析
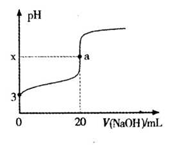
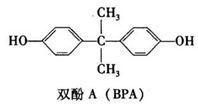

 )。有机物W是碳酸二甲酯的同分异构体,W具有如下特征:
)。有机物W是碳酸二甲酯的同分异构体,W具有如下特征: