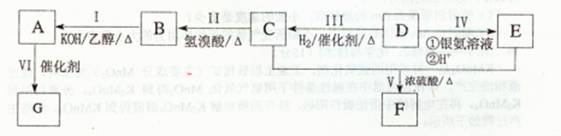
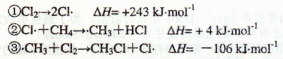-
设NA表示阿伏加德罗常数的值,下列有关说法中正确的是 ( )
A.标准状况下,NA个SO3分子所占的体积约为22.4 L
B.18g重水所含的电子数为10 NA
C.常温下pH=ll的氨水中OH—数等于10—3N
D.llg丙烷中共用电子对数为2.5 NA
难度: 中等查看答案及解析
-
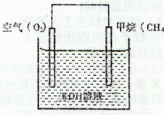
下列装置所示的实验中,能达到实验目的的是 ( )
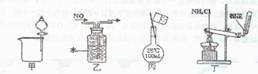
A.图甲可分离碘酒中的碘和酒精
B.图乙可用排水法收集NO气体
C.图丙可用于配制150 mL 0.1 mol/L的盐酸
D.图丁可用于实验室制氨气
难度: 中等查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,D单质既能与强酸反应,又能与强碱反应,元素C与E形成的化合物CE是厨房常用调味品。下列说法正确的是 ( )
A.C、D、E的最高价氧化物对应水化物两两之间能发生反应
B.C和E的单质可通过电解饱和的CE水溶液获得
C.C与B形成的两种化合物中化学键类型完全相同
D.原子半径:C>D>B>A
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A.氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O= AlO—2+4NH+4+ 2H2O
B.将氯气溶于水制备次氯酸:Cl2+H2O
2H++C1—+ClO—
C.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+= Cu2++2Fe2+
D.NaHSO4溶液中滴入Ba(OH)2溶液至SO2-4完全沉淀:
2H++SO2-4+Ba2++2OH—=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
脑白金主要成分的结构简式为
 下列对脑白金主要成分的推论不正确的是 ( )
下列对脑白金主要成分的推论不正确的是 ( )A.其官能团和营养成分与葡萄糖相同 B.其分子式为C13H16N2O
C.该物质能与溴水反应 D.该物质能发生水解反应并生成乙酸
难度: 中等查看答案及解析
-
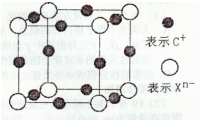
关于下图所示各装置的叙述中,正确的是 ( )
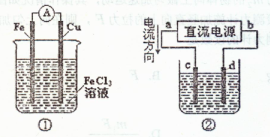
A.装置①是原电池,Fe3+向Fe棒一端移动
B.装置①中Fe为正极,Cu为负极
C.c、d是惰性电极,若用②电解水,电解质溶液可以是K2SO4溶液
D.若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
难度: 中等查看答案及解析
-
下列溶液中离子浓度的关系一定正确的是 ( )
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO2-4-)>c(NH+4)>c(H+)>c(OH-)
B.pH=3的一元酸HX溶液和pH =11的一元碱MOH溶液等体积混合:
c(M+)=c(X)>c(H+)=c(OH-)
C.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液:
c(CH3COO-)>c(CO2-3)>c(C6H5O-)
D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中:
c(K+)=c(H2X)+c(HX-)+c(X2-)
难度: 中等查看答案及解析