-
化学--选修2:化学与技术
KMnO4是一种常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产.即在反应器中碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
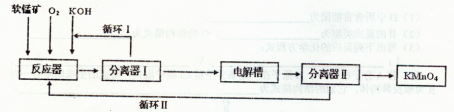
回答下列问题:
(1)写出反应器中反应的方程式______
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量较低的贫矿中Al的氧化物含量较高,会导致KOH消耗量偏离,用离子方程式表示KOH消耗偏高的原因______.
(3)写出电解槽中阴极和阳极的电极反应方程式阴极:______阳极:______.
(4)在传统工艺中,得到K2MnO4后,向其溶液中避入CO2制备KMnO4,配平方程式:K2MnO4+CO2=KMnO4+MnO2+K2CO3将所得到的KMnO4配成0.1mol•L-1 KMnO4溶液,滴定20.00mL未知浓度的FeCl2液,消耗KMnO4溶液30.00mL.滴定达到终点时的现象为:______,则FeCl2溶液的浓度为______mol/L.
-
【化学——选修2:化学与技术】(15分)
KMnO4是一种常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产。即在反应器中碱性条件下用氧气氧化KnO2得到K2MnO4,分离后得到K2MnO4,再在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
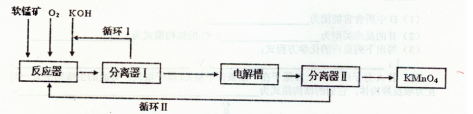
回答下列问题:
(1)写出反应器中反应的方程式_______
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量较低的贫矿中Al的氧化物含量较高,会导致KOH消耗量偏离,用离子方程式表示KOH消耗偏高的原因____。
(3)写出电解槽中阴极和阳极的电极反应方程式阴极:_______ :阳极:____。
(4)在传统工艺中,得到K2MnO4后,向其溶液中避入CO2制备KMnO4,配平方程式:
K2MnO4+_______CO2= _______KMnO4+_______ MnO2+ _______K2CO3
将所得到的KMnO4配成0.1mol·L-1KMnO4溶液,滴定20.00 rnL未知浓度的FeCl2液,消耗KMnO4溶液30.00 mL。滴定达到终点时的现象为:_______ ,则FeCl2溶液的浓度为_______mol/L。
-
[化学——选修2:化学与技术]高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“ 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成K2MnO4、MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成K2MnO4、MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③“电解法”和“ 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为 (列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
-
[化学——选修2:化学与技术]
高锰酸钾( )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
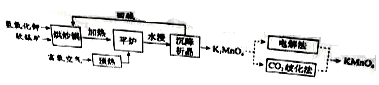
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“ 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
,阴极逸出的气体是 。
③“电解法”和“ 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
-
高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
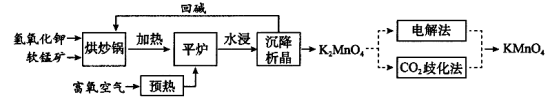
回答下列问题:
(1)“平炉”中发生的化学方程式为 。
(2)“平炉”中需要加压,其目的是 。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③CO2的等电子体COS,分子 COS电子式为_____________。
(4)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液滴定,滴定终点现象 ,该反应中,氧化剂与还原剂的物质的量之比 。
-
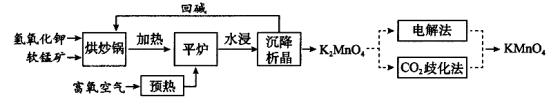
高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
回答下列问题:
(1)“平炉”中发生的化学方程式为 。
(2)“平炉”中需要加压,其目的是 。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③CO2的等电子体COS,分子 COS电子式为_______________。
(4)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液滴定,滴定终点现象 ,该反应中,氧化剂与还原剂的物质的量之比为________________。
-
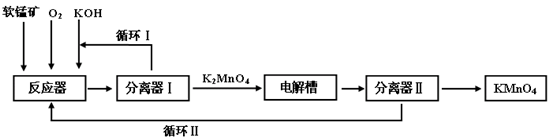
KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2,另含Al2O3、SiO2杂质)为原料,通过液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用铂板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
回答下列问题:
(1)写出反应器中反应的方程式________
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿会导致KOH消耗量偏高,用离子方程式表示KOH消耗偏高的原因________、
________。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极:;阳极:________。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是________。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式:
________K2MnO4+________CO2=________KMnO4+________MnO2+________K2CO3
与传统法相比,液相法的优点是:___________________。
-
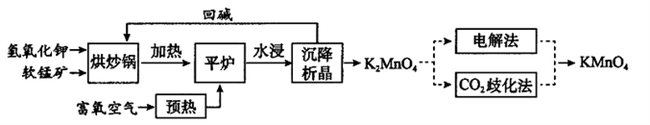
高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是_________________。
(2)“平炉”中发生的化学方程式为_________________,该条件下此反应的△S____0(填大于、小于或等于)。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应生成的含锰物质有KMnO4和MnO2,该反应的化学方程式为__________________。
②“电解法”为现代工艺,即电解K2MnO4水溶液,若用惰性电极,阳离子交换膜电解槽电解时产品纯度高,阴极室中加入电解质溶液溶质的化学式为_______,电解时阳极发生的电极反应为____________,从阳极室的溶液得到产品的实验操作是___________________。与传统工艺比较,现代工艺的优点除产品纯度高外还有_______________。
-
工业上常用软锰矿(主要成分为MnO2)制备KMnO4,,其流程如下所示:
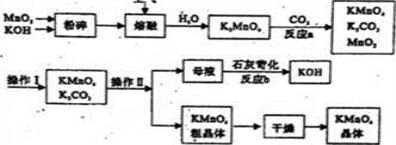
(1)将原料粉碎后,通人空气,加热熔融时,发生反应的化学方程式为_______________。
(2)软锰矿中除了含有MnO2,还含有Fe2O3、MgO、Al2O3、SiO2等杂质,这些杂志会导致KOH消耗量______
(填“偏高”或“偏低”)。
(3)上述过程中可以循环使用的物质有MnO2和_____________(写化学式)。
(4)反应a的化学方程式为________________。
(5)操作I的名称为_________,操作II利用KMnO4和K2CO3溶解性的差异,采取________(填操作方法名称)、趁热过滤得到KMnO4,粗晶体。粗晶体洗涤后得到纯净的晶体。证明晶体已经洗涤干净的操作是______。
(6)某工厂排放的废水中含有Mn2+、Ca2+、Mg2+(阴离子为SO42-),若想将Mn2+回收利用,可利用以下流程:
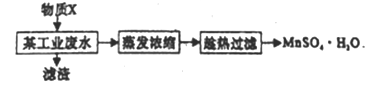
已知:

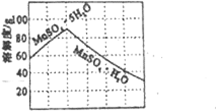
物质X应选用__________(由一种阳离子和一种阴离子组成,填化学式);根据溶解度曲线可知,采用蒸发浓缩、趁热过滤操作时需控制的温度最适宜为___________(填序号)。
①20℃ ②40℃ ③80℃ ④120℃
-
高锰酸钾[KMnO4]是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾[K2MnO4]。下图是实验室模拟制备的操作流程:
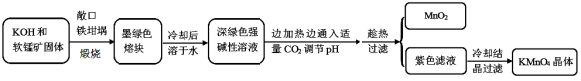
相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42—)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42—会发生歧化反应。
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是______________;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。请写出实验中通入适量CO2时体系中可能发生反应离子方程式 : ;
其中氧化还原反应中氧化剂和还原剂的质量比为_________________________。
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中________ ,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
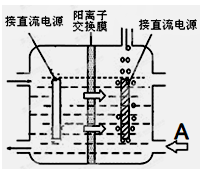
工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式_______________
提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)。使用阳离子交换膜可以提高Mn元素利用率的原因为 ___________________________________。













