-
就在韩美军演即将结束的11月 30日,朝鲜媒体主动曝光,说其离心机正在浓缩铀。已知铀的一种同位素为
,对它的有关认识,正确的是
A.质子数为92 B. 电子数146 C.中子数238 D.元素的相对原子质量23
难度: 中等查看答案及解析
-
2010年上海世博会的主题是“城市,让生活更美好”。下列叙述中不正确的是
A.世博会前期,处理废水时加入明矾可作为净水剂以吸附水中的杂质
B.世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染
C.世博会中国馆——“东方之冠”使用的钢筋混凝土属于高分子化合物
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体
难度: 中等查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是

A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.四个“封管实验”中所发生的化学反应都是可逆反应
D.④中浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
难度: 中等查看答案及解析
-
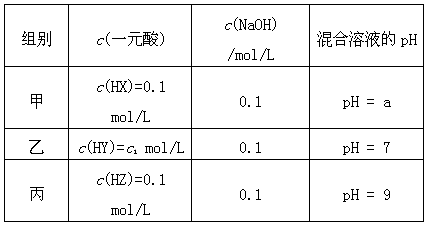
常温时,下列各组离子在指定溶液中能大量共存的是
A.pH = 1的溶液中: Fe2+、NO3-、SO42-、Na+
B.c(Fe3+) = 0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN-
C.c(H+)/c(OH-) = 1012的溶液中: NH4+、Al3+、NO3-、Cl-
D.由水电离的c(H+) = 1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
难度: 中等查看答案及解析
-
常温条件下列溶液中离子浓度的等量关系正确的是
A.0.1 mol/L氨水中:c(NH4+) + c(H+) = c(OH-)
B.0.1 mol/L的NH4Cl溶液中:c(NH4+) = c(Cl-)
C.同为0.1 mol/L的硫酸和氨水等体积混合后:c(NH4+) + c(NH3·H2O) = 2c(SO42-)
D.pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-) = c(H+)
难度: 中等查看答案及解析
-
下列各组单质中,前者能将后者从化合物中置换出来的是
①Al、Fe ②C、Si ③Mg、C ④H2、Cu
A.只有①③ B.①②③④ C.只有②④ D.只有①②
难度: 中等查看答案及解析
-
由氧化铜和氧化铁的混合物a g,加入2 mol·L-1的硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为
A.1.6a g B.(a-1.6) g C.(a-3.2) g D.无法计算
难度: 中等查看答案及解析
-
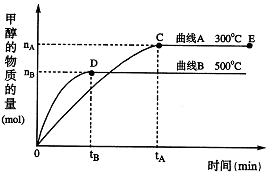
将2mol SO2和1mol O2充入一个容积固定的密闭容器中,在一定温度、催化剂作用下发生反应:2SO2(g)+O2(g)
2SO3(g)。下列哪种量不再变化时,不能说明化学反应已经达到平衡状态的是
A.混合气体的总物质的量 B.混合气体的总压强
C.SO2的转化率 D.混合气体的密度
难度: 中等查看答案及解析