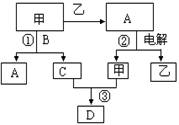
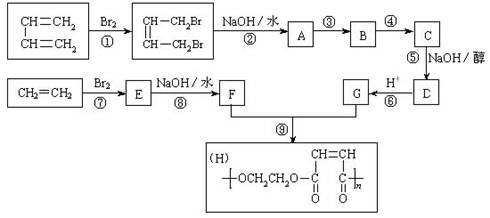
-
下列说法中正确的是( )
①只有一种元素组成的物质,一定是纯净物;②所有酸性氧化物都是非金属氧化物;③硝酸和氢硫酸均既有氧化性又有还原性;④化学反应的实质就是旧化学键断裂、新化学键形成的过程。
A.①② B.③④ C.①②④ D.都正确
难度: 简单查看答案及解析
-
下列比较正确的是( )
① 与冷水的反应速率:K>Na>Mg ② 热稳定性:HF>H2Se>H2S
③ 结合质子的能力:CH3CH2O->CH3COO->HCO3- ④ 离子半径:Cl->O2->Al3+
A.①④ B.②③ C.②④ D.①③
难度: 简单查看答案及解析
-
关于下列四个图像的说法中正确的是( )
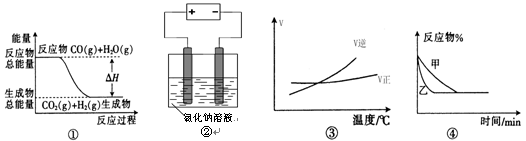
A.图①表示可逆反应“CO(g) + H2O(g)
CO2(g)+H2(g)”中的ΔH大于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③可表示可逆反应“A2(g)+3B2(g)
2AB3(g)”的ΔH小于0
D.图④可表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强大
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA
B.常温常压下,4.6g乙醇中含有C-H键的个数为0.6NA
C.1mol Cl2和1mol H2O充分反应,生成的H+离子数为NA
D.标准状况下,11.2L庚烷完全燃烧后生成的CO2分子数为3.5NA
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.H2O2 + 2OH-
2H2O + O2↑ B.2MnO4- + H2O2 + 6H+ = 2Mn2+ + 3O2↑+ 4H2O
C.2Fe3++H2S=2Fe2++S↓+2H+ D. 3ClO- + 2Fe(OH)3 = 2FeO42- + 3Cl- + H2O + 4H+
难度: 简单查看答案及解析
-
下列对有关实验的说法正确的是( )
A.向盛有碘水的分液漏斗中加入无水乙醇,振荡、静置,放出有机层后再蒸馏,提取碘水中的碘
B.取淀粉、稀硫酸共热后的溶液与新制Cu(OH)2反应,无红色沉淀生成,说明淀粉未水解
C.用浓盐酸酸化KMnO4 溶液以增强其氧化性
D.为除去粗盐中的Ca2+、Mg2+、SO42-,先后加入的试剂是H2O、Ba(OH)2、Na2CO3、HCl
难度: 简单查看答案及解析
-
己烯雌酚是一种激素类药物,结构如右下,下列有关叙述中正确的是( )
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.可分别与NaOH和NaHCO3发生反应
C.1mol该有机物可以与5mol Br2发生反应
D.该有机物分子中,所有碳原子都不可能共平面
难度: 简单查看答案及解析
-
已知反应X(g)+3Y(g)
2Z(g);△H<0,在密闭容器中反应达到平衡时,X物质的量浓度为0.4mol/L。下列说法正确的是 ( )
A.恒温恒容下,通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的1/3
C.恒温下,扩大容器体积至原来的两倍,则X物质的量浓度大于0.4mol/L,
D.恒温恒压下,增加Z的物质的量,重新达平衡时,X物质的量浓度大于0.4mol/L
难度: 简单查看答案及解析