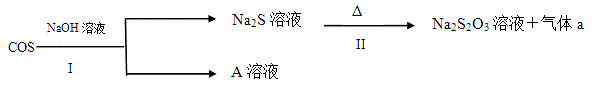-
生活中的一些问题常涉及到化学知识,下列叙述正确的是
A.明矾是常用的水处理剂,可以淡化海水
B.“加碘食盐”、“含氟牙膏”、“富硒营养品”中的碘、氟、硒均以分子形式存在
C.黑火药有硫磺、硝石、木炭三种物质按一定的比例混合而成
D.在食品袋中放入盛有CaCl2 .6H2O和铁粉的透气小袋,可防止食物受潮、氧化变质
难度: 中等查看答案及解析
-
下列与化学概念有关的说法正确的是
A.SiO2、P2O5、NO均为酸性氧化物
B.NaH 、NaBH4 、NaClO均为离子化合物
C.NH3.H2O是弱碱,所以NH4NO3为弱电解质
D.磁性氧化铁、水玻璃、液氨均为混合物
难度: 简单查看答案及解析
-
下列物质的使用不涉及化学变化的是
A.铝热剂焊接钢轨 B.黏土烧结制陶瓷
C.氢氟酸刻蚀玻璃 D.甘油作护肤保湿剂
难度: 中等查看答案及解析
-
下列有关金属及其化合物的说法正确的是
A.除去MgCl2溶液中少量的FeCl3,可选用MgO
B.Na久置与空气中最终生成NaHCO3
C.铝、铁、铜在空气中长时间放置,表面均只生成氧化物
D.向NaOH溶液中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
难度: 中等查看答案及解析
-
下列与实验相关的叙述,正确的是
A.浓硝酸存放在带橡胶塞的棕色玻璃瓶中
B.四氯化碳萃取溴水中的溴时,水从分液漏斗下口流出
C.向饱和的NaCl溶液中通入足量的NH3后,再通入CO2,有晶体析出
D.某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.20gH218O和20gD2O中含有的中子数均为10NA
B.标准状况下,11.2LO2参加反应转移的电子数一定是2NA
C.1L的生理盐水(0.9%NaCl溶液)中含有Na+数为9NA
D.标准状况下,分子数为NA的NO2、N2O4混合气体体积约为22.4L,质量为46g
难度: 简单查看答案及解析
-
下列反应对应的离子方程式正确的是
A.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:
HCO3- + Ca2++OH-=CaCO3↓+H2O
B.过氧化钠溶于水:2022-+2H2O=4OH-+O2↑
C.用MnO2从酸化的海带灰中浸取液中提取碘:MnO2+2I-+2H2O=Mn2++I2+4OH-
D.向偏铝酸钠溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
难度: 简单查看答案及解析
-
下列有关氯及其化合物叙述错误的是
A.红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟
B.大量氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻身向高处跑
C.AlCl3 、FeCl2 、FeCl3均可通过化合反应制得
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
难度: 简单查看答案及解析
-
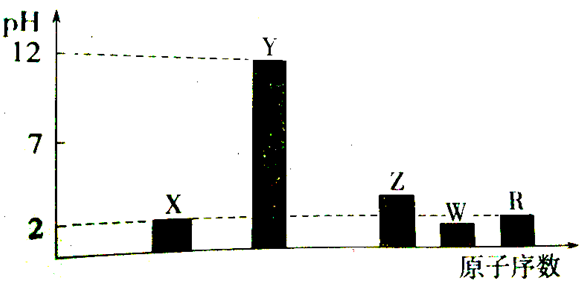
右表所示的五种元素中,W、X、Y、Z为短周期元素,W元素的核电荷数为X元素的2倍。下列说法错误的是
X
Y
W
Z
T
A.气态氢化物稳定性:Z > W
B.简单离子半径:X < Y
C.液态WZ4气化需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性
难度: 中等查看答案及解析
-
下列现象或事实可以用同一原理解释的是
A.浓硫酸和浓盐酸长期露置在空气中浓度均降低
B.氯化铵和碘都可以用加热的方法进行提纯
C.氯水、SO2均能使品红溶液褪色
D.溴蒸汽和NO2气体都能使湿润的淀粉碘化钾试纸变蓝
难度: 中等查看答案及解析
-
根据下表的信息判断,下列说法错误的是
序号
反应物
产物
①
Cl2 、 H2O2
Cl-
②
Cl2 、FeI2
FeCl2 、I2
③
KClO3 、HCl
Cl2 、KCl 、H2O
A.第①组反应的氧化产物为O2
B.第②组反应中Cl2 和FeI2的物质的量之比小于或等于1:1
C.第③组反应中生成1molCl2转移6mol电子
D.氧化性由强到弱的顺序为ClO3- >Cl2 >I2
难度: 简单查看答案及解析
-
已知下列转化关系中,甲、乙均为单质,下列判断正确的是
甲+乙
丙
丙溶液
甲+乙
A.甲可能是钠 B.乙可能是氢气
C.丙可能是氧化铝 D.丙可能是三氧化硫
难度: 简单查看答案及解析
-
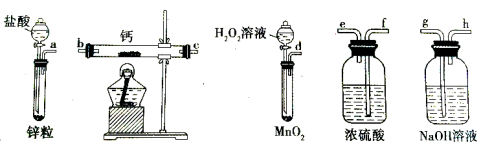
探究铜和浓硫酸的反应,下列装置或操作错误的是
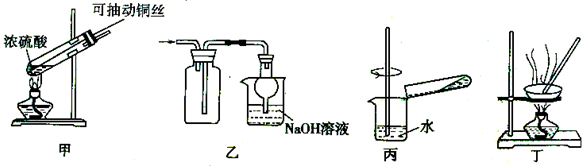
A.上下移动装置甲中的铜丝可控制生成SO2的量
B.装置乙可用于收集SO2气体
C.为确认CuSO4生成,将试管中的液体倒入装置丙中稀释,观察颜色
D.利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4 .5H2O
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:Al3+ 、NH4+ 、Cl- 、HS-
B.水电离出的C(H+)=1×10-13 mol.L-1的溶液中:Ca2+ 、HCO3- 、I- 、NO3-
C.弱酸性溶液中:Na+ 、NH4+ 、HSO3- 、Cl-
D.漂白粉的水溶液中:Fe2+ 、SO42-、 Mg2+、 Na+
难度: 简单查看答案及解析
-
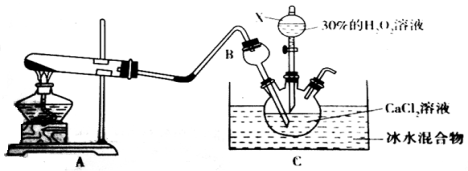
利用右图所示的装置进行下列实验,预测的现象和实际相符的是
选项
①中的物质
②中的物质
③中的物质
预测③中的现象
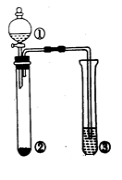
A
浓氨水
NaOH
AlCl3溶液
先产生白色沉淀,后沉淀溶解
B
浓盐酸
MnO2
KI溶液
溶液变蓝色
C
浓硫酸
Na2SO4
Ba(NO3)2溶液
无沉淀生成
D
浓硝酸
Cu
含酚酞的NaOH溶液
溶液红色褪去
难度: 简单查看答案及解析
-
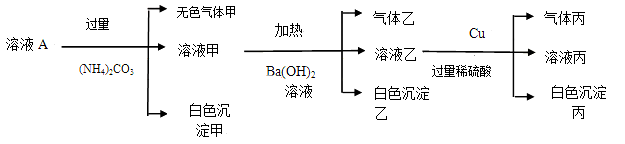
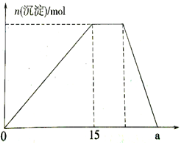
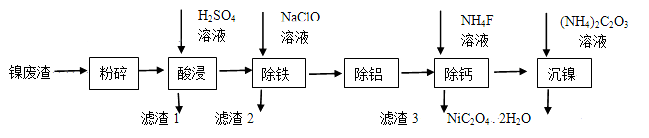
某矿物X由Al2O3、Fe2O3、Cu2O、SiO2中的一种或几种物质组成。现进行如图所示实验:
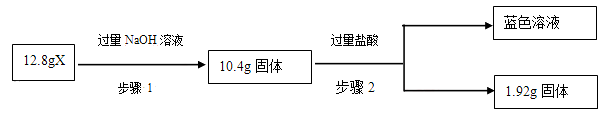
(已知:Cu2O+2H+=Cu+Cu2++H2O)
A.步骤1中减少的固体一定是混合物
B.根据上述步骤可以判断矿物X中
< 1
C.根据步骤2可以得出蓝色溶液中n(Cu2+)=0.02mol
D.根据步骤1、2可以判断出X中氧化铁的质量分数为50%
难度: 中等查看答案及解析