-
下列物质:①盐酸 ②食盐水 ③熔化的氯化钠 ④液态氯化氢 ⑤铜 ⑥氨水 ⑦SO3 ⑧醋酸,其中可以导电并且属于强电解质的是( )
A.只有③ B.①②③⑥⑧ C.④⑤ D.全部都是
难度: 中等查看答案及解析
-
常温时,pH值为3的CH3COOH和pH为11的NaOH溶液等体积混合,混合后溶液pH为( )
A. pH>7 B.pH< 7 C.pH=7 D.无法判断
难度: 中等查看答案及解析
-
常温时,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为 ( )
A. A>B B. A=10-4 B C. B=10-4 A D. A=B
难度: 中等查看答案及解析
-
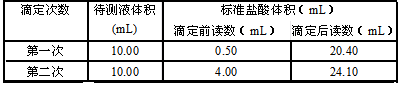
某学生的实验报告所列出的下列数据中合理的是 ( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液pH为2.3
D.用25mL滴定管中和滴定时,用去某浓度碱溶液21.70mL
难度: 中等查看答案及解析
-
室温时,M(OH)2(s)
M2+(aq)+2OH-(aq) Ksp=a; c(M2+)=b mol · L -1时,溶液的pH等于
A.
B.
C.14+
D.14+
难度: 中等查看答案及解析
-
当用标准盐酸溶液滴定待测氢氧化钠溶液时,下列操作中会使测定结果偏低的是( )
A.用酸式滴定管滴至终点时,俯视滴定管读数
B.将碱液移入锥形瓶后,加了10 ml蒸馏水再滴定
C.酸式滴定管用蒸馏水润洗后,未用标准盐酸溶液润洗
D.酸式滴定管注入酸液时,尖嘴处留有气泡,达滴定终点时气泡消失
难度: 中等查看答案及解析
-
一定温度,甲乙两氨水浓度分别为1mol/L和0.1mol/L,则甲、乙两氨水中c(OH—)之比为 ( )
A. 大于10 B. 小于10 C. 等于10 D. 无法确定
难度: 中等查看答案及解析
-
为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入①适量的HCl②适量的NaCl③适量的氨水④适量的NaOH,正确的是( )
A.①② B.③ C.③④ D.④
难度: 中等查看答案及解析
-
物质的量浓度相等的下列溶液pH值由大到小的顺序是( )
A.Na2CO3、NaHCO3、NaCl、NH4Cl B.Na2CO3、NaHCO3、NH4Cl、NaCl
C.Na2CO3、NaCl、NH4Cl、NaHCO3 D.Na2CO3、NH4Cl、NaHCO3、NaCl
难度: 中等查看答案及解析
-
在蒸发皿中加热蒸干下列物质的水溶液并灼烧(低于400℃),可以得到该物质固体的是( )
A.氯化铝 B.碳酸氢钾 C.偏铝酸钠 D.高锰酸钾
难度: 中等查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离常数(25℃)
Ka=1.77×104
Ka=4.9×10-10
Ka1=4.3×107 Ka2=5.6×1011
下列选项错误的是( )
A.CN―+H2O+CO2=HCN+HCO3―
B.2HCOOH+CO32―=2HCOO―+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
难度: 中等查看答案及解析
-
在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH 溶液,曲线如下图所示,有关粒子浓度关系比较正确的 ( )
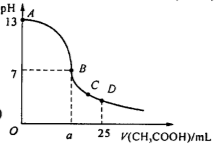
A.在A、B间任一点,溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)= c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
难度: 中等查看答案及解析
-
实验测得常温下
某一元酸(HA)溶液pH≠1,
某一元碱(BOH)溶液里
,将这两种溶液等体积混合,所得溶液各离子物质的量浓度由大到小顺序是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
某酸的酸式盐NaHY的水溶液显碱性,下列有关叙述正确的是 ( )
A.H2Y的电离方程式为:H2Y
2H++Y2—
B.在该盐的溶液里,离子浓度为:c(Na+)>c(Y2—)>c(HY—)>c(OH—)>c(H+)
C.在该盐的溶液里,离子浓度为:c(Na+)>c(HY—)> c(OH-)> c(Y2—)
D.HY—水解方程式为:HY—+H2O
H3O++ Y2—
难度: 中等查看答案及解析
-
下图表示溶液中c(H+)和c(OH-)关系,下列判断错误的是
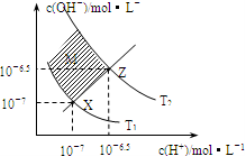
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
难度: 中等查看答案及解析
-
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3―+ H2O
H2SO3 + OH― ① HSO3―
H+ + SO32― ②
向0.1 mol · L -1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3―)增大
B.加入少量Na2SO3固体,则c(H+) + c(Na+) = c(HSO3―) + c(OH―) +
c(SO32―)
C.加入少量NaOH溶液,
、
的值均增大
D.加入氨水至中性,则2c(Na+) = c(SO32―)>c(H+) = c(OH―)
难度: 困难查看答案及解析
-
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
起始浓度/(mol · L -1)
反应后溶液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
mol · L -1
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol · L -1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
难度: 困难查看答案及解析
-
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.Na2CO3;c.NaHCO3;d.NaOH,其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2 c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.③⑤⑥ B.③④⑥ C.④⑤⑥ D.①②④
难度: 困难查看答案及解析
-
现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
pH
11
11
3
3
A.分别加水稀释10倍,四种溶液的pH:①>②>④>③
B.温度下降10℃,四种溶液的pH均不变
C.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
D.将①、④两种溶液等体积混合,所得溶液中:
难度: 中等查看答案及解析
-
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lgc(M),p(CO
)=-lgc(CO
)。下列说法正确的是( )
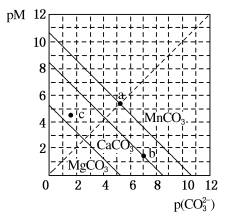
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)>c(CO
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO
)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO
)
难度: 中等查看答案及解析