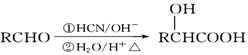-
化学与生产、生活、社会密切相关。下列说法中不正确的是 ( )
A. “硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致.
B. 加入Na2S可消除污水中Hg2+ 的污染。
C. 氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以它们的含量是空气质量报告的主要项目
D. 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH
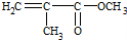 ,其过程符合绿色化学的原则
,其过程符合绿色化学的原则难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18克的D216O中含有的中子数为9NA
B.标准状况下,22.4LSO3含有的原子数为4NA
C.80ml10mol/L盐酸与足量MnO2加热反应,产生的Cl2分子数为0.2NA
D.精炼铜过程中,阳极质量减少6.4g时,电路中转移电子为0.2 NA
难度: 中等查看答案及解析
-
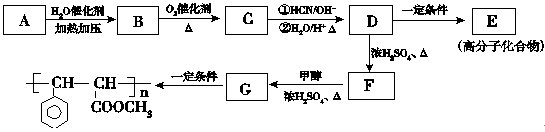
涤纶广泛应用于衣料和装饰材料。合成涤纶的反应如下:
下列说法正确的是
A. 合成涤纶的反应为加聚反应
B. 对苯二甲酸和苯甲酸互为同系物
C. 1 mol涤纶与NaOH溶液反应,理论上最多可消耗2n mol NaOH
D. 涤纶的结构简式为:
难度: 中等查看答案及解析
-
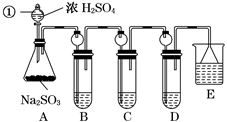
某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是 ( )

A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
难度: 困难查看答案及解析
-
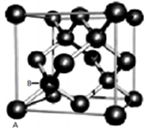
短周期元素W、X、Y和Z的原子序数依次增大,元素W是制备一种高效电池的重要材料, X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是 ( )
A. 元素Z可与元素X形成共价化合物XZ2
B. 元素X与氢形成的原子比为1:1的化合物有很多种
C. 元素W、X的氯化物中,各原子均满足8电子的稳定结构
D. 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
难度: 中等查看答案及解析
-
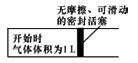
太阳能光电池由于具有充电快、寿命长等特点,适于很多特殊环境和场合,现已得到广泛应用。氮化稼(GaN)光电池的结构如图所示。下列说法中正确的是( )
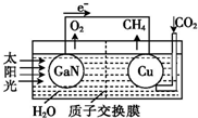
A. 该装置系统中只存在两种能量转化
B. Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O
C. 离子交换膜为质子交换膜,H+从右池移向左池
D. 常温下,当装置中有lmolCH4生成时,GaN电极有44.8LO2生成(不考虑O2的溶解性〕
难度: 中等查看答案及解析
-
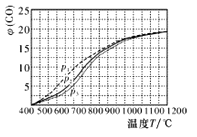
下图所示与对应叙述相符的是
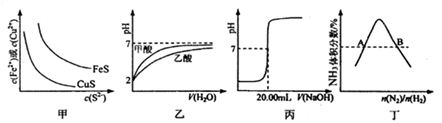
A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g)
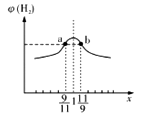
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
难度: 困难查看答案及解析