-
下列有关说法正确的是
A.已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-
I2+I-
B.物质的量浓度相等的H2CO3和Na2CO3溶液等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
难度: 困难查看答案及解析
-
常温下,下列关于电解质溶液的说法正确的是
A.将pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小
B.用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液)
C.向0.2 mol/L的盐酸溶液中加入等体积0.1 mol·L-1 NH3·H2O溶液:c(Cl–)+c(OH–)=c(H+)+c(NH3·H2O)
D.在含0.1mol NaHSO4的溶液中:c(H+)=c(SO42-)+c(OH–)
难度: 困难查看答案及解析
-
化学与生活息息相关,下列说法不正确的是
A.食用油不宜长时间高温反复使用
B.汽车尾气中的NO是氮气和氧气在高温下反应产生的
C.门窗玻璃和玛瑙手镯所用材料的主要成分都是硅酸盐
D.不锈钢在空气中非常稳定,是因为不锈钢表面形成了一层很薄的含铬氧化物致密膜,有效地保护内层金属
难度: 中等查看答案及解析
-
在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
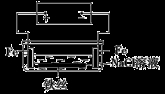
A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色
C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+
D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
难度: 困难查看答案及解析
-
下列事实一定能说明HF是弱酸的是
A.常温下NaF溶液的pH大于7
B.HF能与Na2CO3溶液反应,产生CO2气体
C.1mol/L的HF水溶液能使紫色石蕊试液变红
D.用HF溶液做导电性实验,灯泡很暗
难度: 中等查看答案及解析
-
在一定条件下,Na2CO3溶液存在水解平衡:
。下列说法正确的是
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡朝正反应方向移动
C.升高温度,
减小
D.加入NaOH固体,溶液pH减小
难度: 困难查看答案及解析
-
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是

A.ZY、ZW、W2X的水溶液都显酸性
B.原子半径大小:W>R>X,简单离子半径大小:R >W >X
C.W的氢化物与R的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W
D.Z与X、Z与R两种元素形成的化合物中均可能存在共价键
难度: 困难查看答案及解析