-
下列说法正确的是( )
A.多数合金的熔点比其组成金属的高
B.陶瓷、塑料、橡胶是常说的三大合成材料
C.油脂是重要的体内能源,是人体不可缺少的营养物质
D.以NaClO为有效成分的漂白液不能作游泳池和环境的消毒剂难度: 中等查看答案及解析
-
石墨烯是碳原子构成的单层二维蜂窝状晶格结构(如图所示)的一种碳质新材料,是构建富勒烯、纳米碳管的基本单元,有广泛的用途.下列说法正确的是( )
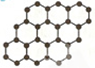
A.石墨烯是一种有机物
B.石墨烯中碳原子间以共价键结合
C.石墨烯具有和乙烯相同的性质
D.12g石墨烯中约含6.02×1023个e-难度: 中等查看答案及解析
-
主族元素W、X、Y、Z位于同一周期,原子序数依次增大,.Y、Z是非金属元素.W、X的最高价氧化物对应的水化物可以相互反应,W与Y可形成化合物W2Y,Y的最外层电子数是核外电子层数的2倍.下列说法正确的是( )
A.Y的气态氧化物比Z的气态氢化物稳定
B.W的最高价氧化物对应的水化物是已知最强的碱
C.Y单质和氧气、氢气都能发生化合反应,且产物都具有还原性
D.W、X、Y、Z四种元素的原子半径由小到大的顺序是:W<X<Y<Z难度: 中等查看答案及解析
-
下图所示实验装置不能达到实验目的是( )
A.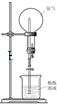
喷泉实验
B.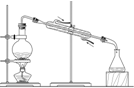
实验室制乙烯
C.
酯化反应
D.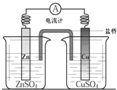
铜锌原电池难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.25℃时,MgCO3饱和溶液中c(Mg2+)=2.6×10-3mol•L-1,CaCO3饱和溶液中c(Ca2+)=5.3×10-5mol•L-1,向浓度均为0.1 mol•L-1的MgCl2和CaCl2混合溶液中逐滴加入0.1 mol•L-1的Na2CO3溶液,首先生成CaCO3沉淀
B.向硫酸亚铁溶液中加入氯水,再加入KSCN溶液,溶液变为红色,说明硫酸亚铁溶液中存在Fe3+
C.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42-
D.除去Cu粉中混有的CuO,可将混合物加入到稀硝酸中,充分反应后过滤、洗涤难度: 中等查看答案及解析
-
已知:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ•mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
现有H2和CH4的混合气体112L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,则原混合气体中H2和CH4的物质的量之比是( )
A.1:1
B.1:3
C.1:4
D.2:3难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3-=4Mg2++NH4++3H2O
B.25℃时,将20 mL 0.1 mol•L-1 H2SO4溶液和30 mL 0.15 mol•L-1 NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11
C.将10 mL 0.1 mol•L-1 KAl(SO4)2溶液和10 mL 0.2 mol•L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2
D.浓度均为0.1 mol•L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)难度: 中等查看答案及解析