-
下列事实与原因对应关系不正确的是( )
A B C D
图片




推广使用无铅汽油 吃水果有益于身体健康 通常在船身上装锌块 钢化玻璃常用于制造汽车或火车车窗
主要 减少铅污染 水果中富含蛋白质等营养物质 防止钢铁发生腐蚀 钢化玻璃强度大,且破碎后,碎块没有尖锐棱角
难度: 中等查看答案及解析
-
下列叙述正确的是
A.金属单质都能导电,非金属单质都不能导电
B.离子化合物一定不含有共价键
C.只含有共价键的物质一定是非电解质
D.CaCl2在熔融状态下可导电,它是强电解质
难度: 中等查看答案及解析
-
下列关于C、Si、S、Cl四种元素的说法中,正确的是
A.在自然界中都能以游离态存在
B.两两结合形成的化合物都是共价化合物
C.氢化物的热稳定性比较:CH4>SO42->IO3->I2
D.反应①、②中生成等量的I2时转移电子数比为1:5
难度: 中等查看答案及解析
-
据报道,科学家已成功合成了少量的O4,下列说法正确的是
A.1 mol18O4中含有72mol中子
B.O4与O3、O2互为同位素
C.相同质量的O4与O3所含原子个数之比为1:1
D.标准状况下22.4LO4、O3、O2所含的电子数相等
难度: 中等查看答案及解析
-
新修订的《环境空气质量标准》增设了PM2.5浓度限值和臭氧8小时平均浓度限值等。PM2.5是指空气中直径为2.5×10-6m的固体颗粒或液滴的总称。下列说法错误的是
A.PM2.5分散在空气中可形成胶体
B.高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障
C.低空的臭氧是污染气体,会给人体造成伤害
D.化石类燃料的燃烧、含硫矿石的冶炼等过程都是造成SO2污染的重要原因
难度: 中等查看答案及解析
-
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”获得2011年诺贝尔化学奖。某准晶体由一定比例的铁、铜、铝组成,取两小块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投人烧杯②中,注入稀硫酸浸没固体。下列分析合理的是
A.在烧杯①中,若构成微型电池,负极反应式为2H2O十2e-=2OH-+H2↑
B.在烧杯②中,若铁、铜构成微型电池,则铜为负极
C.在烧杯①中,若构成微型电池,铝为负极
D.在烧杯②中,向溶液中滴加KSCN溶液,溶液一定变为红色
难度: 中等查看答案及解析
-
在压强为2.20×104kPa、温度达到374℃时,水成为“超临界状态”,此时水可与CO2等含碳化合物反应生成有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法错误的是
A.火力发电厂可望利用废热,通过水热反应将二氧化碳转变为能源物质
B.“水热反应”是一种复杂的物理化学变化
C.超临界水与普通水的组成不相同
D.随着科技的进步,通过“水热反应”获取能源有望实现地球上碳资源的和谐循环
难度: 中等查看答案及解析
-
下列说法或反应无法实现的是
A.酸性氧化物与碱发生反应
B.盐溶液与弱酸反应生成强酸
C.能发生复分解反应,但既没有水生成,也没有沉淀和气体生成
D.改变温度或压强,使合成氨反应中原料的转化率达到100%
难度: 中等查看答案及解析
-
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>SO42->IO3->I2
D.反应①、②中生成等量的I2时转移电子数比为1:5
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4L任意比的氢气与氧气的混合气体中的分子总数均为2NA
B.标准状况下,22.4L水中含有NA个O—H键
C.足量铜与1L18mol·L-1浓硫酸反应可以生成SO2分子总数为9NA
D.100mL0.1mol·L-1HNO3溶液中含有0.01NA个NO3-
难度: 中等查看答案及解析
-
从海水中提取部分物质的过程如下图所示
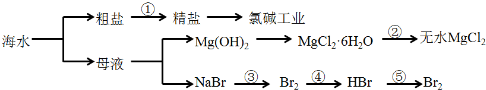
下列有关说法错误的是
A.过程①需要加入化学试剂、沉淀、过滤等操作
B.由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C.工业上一般用金属钠与无水MgCl2反应制取Mg单质
D.反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O
B.以石墨作电极电解CuCl2溶液:2Cl-+2H2O
2OH-+H2↑+Cl2↑
C.铜跟浓硝酸反应:Cu+4HNO3(浓)= Cu2++2NO3-+2NO↑+2H2O
D.NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
对于平衡体系mA(g)+nB(g)
pC(g)+qD(g) △H<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则向含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D.保持其它条件不变,升高温度,平衡向正反应方向移动
难度: 困难查看答案及解析
-
下列离子能在溶液中大量共存,当将溶液的pH调节至1时就会出现浑浊的是
A.Fe2+、Fe3+、NH4+、NO3- B.S2-、K+、I-、SO32-
C.Na+、I-、CO32-、NO3- D.Al3+、HCO3-、OH-、Na+
难度: 中等查看答案及解析
-
某同学想用实验证明FeCl3溶液显黄色不是氯离子造成的,下列实验无意义的是
A.观察KCl溶液没有颜色
B.向FeCl3溶液中滴加适量NaOH溶液,振荡静置,过滤后所得滤液黄色消失
C.向FeCl3溶液中滴加适量AgNO3溶液,振荡静置,过滤后所得滤液黄色未消失
D.加水稀释后FeCl3溶液黄色变浅
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论或相应的解释错误的是
选项 实验操作 实验现象 结论或解释
A 向盛有0.5mol•L-1 Fe(NO3)2溶液的试管中加入0.5mol•L-1 H2SO4溶液 在试管口处出现红棕色气体 溶液中NO3-被Fe2+还原为NO2
B 向PbI2饱和溶液中滴加几滴0.1mol•L-1 KI溶液 出现黄色沉淀 说明 PbI2饱和溶液中有Pb2+存在
C 向白色ZnS沉淀上滴加0.1mol•L-1 CuSO4溶液,振摇 沉淀变为黑色 ZnS沉淀转化为CuS沉淀
ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)
D 用1mol•L-1醋酸溶液和1mol•L-1盐酸分别做导电性实验 醋酸溶液对应的灯泡较暗 醋酸是弱电解质
难度: 中等查看答案及解析