-
下列对化学反应的认识,错误的是( )
A.会引起化学键的变化
B.会产生新物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )元素代号 X Y Z W 原子半径/pm 160 143 70 66 主要化合价 +2 +3 +5、+3、-3 -2
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成2W2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来难度: 中等查看答案及解析
-
下列说法正确的是( )
A.原子最外层电子数等于或大于3(小于8)的元素一定是非金属元素
B.原子最外层只有1个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的元素一定位于第二周期
D.同周期ⅡA族与ⅢA族元素的原子序数之差一定为1难度: 中等查看答案及解析
-
2011年3月12日,日本9.0级大地震引起福岛核电站大爆炸,大量的放射性核素53125I,53131I,55131CS释放出来;下列说法正确的是( )
A.53125I与53131I互为同位素
B.53131I与55131CS互为同位素
C.53131I与55131CS质子数相等
D.53131I与55131CS中子数相等难度: 中等查看答案及解析
-
下列物质中含有化学键种类相同的是( )
A.NaF和H2O
B.D2O与TCl
C.Na2O与CO2
D.氢气与氦气难度: 中等查看答案及解析
-
“节能减排、发展低碳经济”成为世界经济发展的共同目标.下列措施不符合这一经济发展目标的是( )
A.研究新技术,开发和利用好新能源,减少化石燃料的燃烧
B.加大CO2的捕集、利用与封存等低碳和零碳技术的研发和产业化投入
C.研究节能技术、提高能效,开发洁净煤新技术,充分利用好可再生能源
D.废弃塑料、橡胶等有机高分子化合物实行燃烧处理,产热发电难度: 中等查看答案及解析
-
已知元素X的一种核素的质子数为Z,中子数为N,下列说法正确的是( )
A.X元素的质量数为(Z+N)
B.元素X的相对原子质量为Z+N
C.1molX的质量为(Z+N)g
D.不能由此确定元素X的相对原子质量难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.37Cl-所含有的电子数为18NA
B.实验室用MnO2与浓盐酸制取11.2L氯气,转移电子数为NA
C.标准状况下,22.4L35Cl2气体所含中子数为36NA
D.18gD2O与18gH2O含有电子数都为10NA难度: 中等查看答案及解析
-
利用下列化学反应可以设计出原电池的是( )
A.CaO+H2O=Ca(OH)2
B.NaOH+HCl=NaCl+H2O
C.Cu+2HCl=CuCl2+H2↑
D.Cu+2FeCl3=CuCl2+2FeCl2难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,电子式为如图所示:下列说法正确的是( )
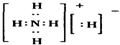
A.NH5属于离子化合物
B.NH5属于共价化合物
C.NH5只含有离子键
D.NH5只含有共价键难度: 中等查看答案及解析
-
原子序数大于4的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,据此推断正确的是( )
A.A和B所属同周期
B.A和B的核电荷数之差为m+n
C.B和A的族序数之差为n-m
D.m+n=8难度: 中等查看答案及解析
-
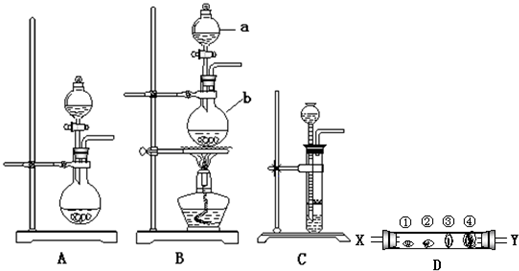
等质量的铁与过量的盐酸在不同条件下进行反应,测量在不同时间t产生的气体体积V的数据,根据数据绘制得到下图,则曲线b对应的实验组可能是( )
组别 C(HCl)/mol/L 温度/℃ 铁的状态 A 2.0 25 块状 B 2.5 30 块状 C 2.5 50 块状 D 2.5 30 粉末状 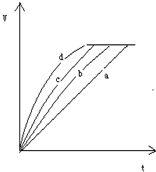
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充人1molN2和3molH2,在一定条件下使该反应发生N2+3H2
2NH3,有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.在化学反应中发生能量变化的主要原因是物质中化学键的断裂和形成
B.离子键是相邻阳离子、阴离子间的静电作用
C.根据电离方程式HCl═H++Cl-,判断HCl分子里存在离子键
D.一个确定的化学反应是吸热反应还是放热反应,决定于反应物的总能量与生成物的总能量的相对大小难度: 中等查看答案及解析
-
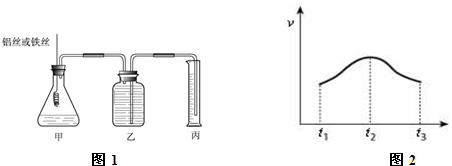
下列各装置不能达到实验目的是( )
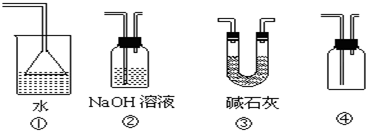
A.利用①吸收多余的氨气
B.装置②可用于除去Cl2中的HCl
C.装置③可用于干燥氨气
D.装置④可用于排空气法收集H2、CO2、Cl2、HCl等气体难度: 中等查看答案及解析
-
关于如图所示的装置的叙述,正确的是( )
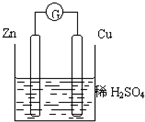
A.电流从锌片经导线流向铜片
B.一段时间后,电解质溶液中的硫酸根浓度减小
C.铜是正极,铜片上有气泡产生,锌片质量减少
D.一段时间后,电解质溶液的酸碱性保持不变难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X+无电子,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,且含Z元素的物质焰色反应为黄色.下列说法正确的是( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y与元素Z形成的化合物中阴阳离子之比一定为1:2
D.元素X、Y、Z形成的化合物中含有共价键,因此是共价化合物难度: 中等查看答案及解析