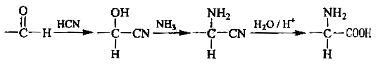
-
下列关于有机物的说法正确的是( )
A.实验室制备硝基苯加入试剂的顺序为:先加入浓硫酸,再滴加苯,最后滴加浓硝酸
B.蔗糖和葡萄糖不是同分异构体,但属同系物
C.可用金属钠区分乙酸、乙醇和苯
D.石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列叙述错误的是( )
A.46gNO2和N2O4混合气体中含有原子总数为3NA
B.常温常压下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应小于0.1NA
C.12g金刚石中含有的共价键数为2NA
D.2.1gDTO中所含中子数为NA
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH—(aq)═H2O(l)△H=-57.3kJ/mol
B.向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:
3NH4++Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
C.淀粉碘化钾溶液在空气中变蓝:4I—+O2+4H+═2I2+2H2O
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32—+6H++2MnO4—═5SO42—+2Mn2++3H2O
难度: 困难查看答案及解析
-
为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W0 g样品进行实验,下列实验方法所对应的实验方案和测量数据最合理(除W0外)的是( )
实验方法
实验方案
测量数据
A A.
滴定法
将样品配成100 mL溶液,取10 mL,加入甲基橙,用标准盐酸滴定
消耗盐酸的体积
B B.
量气法
将样品与盐酸反应,生成的气体全部被碱石灰吸收
碱石灰增重
C C.
重量法
样品放入烧瓶中,置于天平上,加入足量盐酸
减轻的质量
D D.
量气法
将样品与盐酸反应,气体通过排水量气装置量气
排水体积
难度: 中等查看答案及解析
-
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—离子中的两种组成,可以发生如图转化,下列说法不正确的是( )
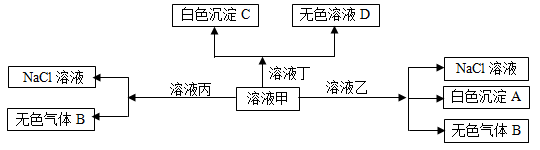
A.在甲中滴加丁可能发生反应:HCO3—+ Ba2++OH—= BaCO3↓+ H2O
B.溶液丙中还可以大量共存的离子有:I—、NO3—、SO42—
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为 AlCl3
难度: 困难查看答案及解析
-
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)
4NO(g)+6H2O(g)△H=-9072kJ·mol-1K=1.1×1026
②4NH3(g)+4O2(g)
2N2O(g)+6H2O(g)△H=-1104.9kJ·mol-1K=4.4×1028
③4NH3(g)+3O2(g)
2N2(g)+6H2O(g)△H=-1269.02kJ·mol-1K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高单位时间内NO的产率,最合理的措施是()
A.增大O2浓度 B.使用合适的催化剂 C.减小压强 D.降低温度
难度: 中等查看答案及解析
-
X、Y、Z、W四种短周期元素,有关数据如下表:
元素代号
X
Y
Z
W
原子半径/pm
66
70
143
160
主要化合价
-2
+5、+3、-3
+3
+2
下列叙述正确的是()
A.W和Y形成的化合物中含有离子键和非极性键
B.一定条件下,X单质可以将Y单质从其氢化物中置换出来
C.Z的最高价氧化物能溶于氨水
D.Y的简单气态氢化物的沸点高于X的简单气态氢化物
难度: 中等查看答案及解析



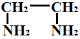 ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为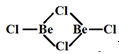
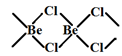
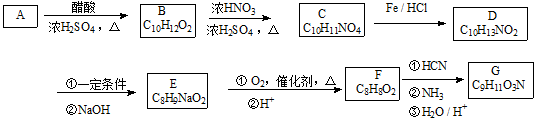
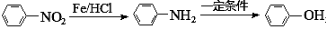 ;
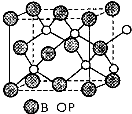
;