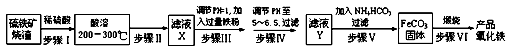-
(14分)工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为 ;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 、玻璃棒和烧杯等;步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是 ;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 ;
(5)步骤Ⅵ中发生反应的化学反应方程式为 ;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol·L-1。试判断所得的FeCO3中是否含有Fe(OH)2 (填“是”或“否”),请通过简单计算说明理由。
(已知:Ksp[Fe(OH)2]=4.9×10-17);
(7)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为 。
-
工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料--铁红(Fe2O3),具体生产流程如下:
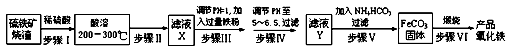
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为_________________;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有_______、玻璃棒和烧杯等;步骤Ⅳ中应选用______试剂调节溶液的pH(填字母编号).
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是_______;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是____________;
(5)步骤Ⅵ中发生反应的化学反应方程式为__________________;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中是否含有Fe(OH)2_____(填“是”或“否”),请通过简单计算说明理由.(已知:Ksp[Fe(OH)2]=4.9×10-17)__________________。
(7)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为___________。
-
工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为 ;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 、玻璃棒和烧杯等;步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是 ;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 ;
(5)步骤Ⅵ中发生反应的化学反应方程式为 ;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol·L-1。试判断所得的FeCO3中是否含有Fe(OH)2 (填“是”或“否”),请通过简单计算说明理由。(已知:Ksp[Fe(OH)2]=4.9×10-17) ;
(7)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为 。
-
工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料-铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)步骤1若改用稀硝酸,则Fe3O4发生反应的离子反应方程式为__;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有____、玻璃棒和烧杯等;步骤Ⅳ中应选用__试剂调节溶液的pH(填字母编号).
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是__;
(4)步骤Ⅵ中发生反应的化学反应方程式为__;
(5)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为9.5,c(Fe2+)=1×10﹣6 mol/L.试判断所得的FeCO3中是否含有Fe(OH)2, 并请通过简单计算说明理由______.(已知:Ksp[Fe(OH)2]=4.9×10﹣17)
-
工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料﹣﹣铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)步骤Ⅰ若用稀硫酸,则Fe3O4发生反应的离子反应方程式为__________;
(2)实验室实现“步骤Ⅰ”中分离操作所用的玻璃仪器有__________________;步骤Ⅲ中应选用_____试剂调节溶液的pH(填字母编号).
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是_____________________;
(4)煅烧过程中发生反应的化学反应方程式为___________________;
(5)步骤Ⅳ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为9.5,c(Fe2+)=1×10﹣6 mol/L.试判断所得的FeCO3中是否含有Fe(OH)2,请通过简单计算说明理由_________________.(已知:Ksp[Fe(OH)2]=4.9×10﹣17).
(6)欲测定硫铁矿矿渣中Fe元素的质量分数,称取5.6 克样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体4.2克,测得该样品中Fe元素的质量分数为_______________(保留三位有效数字).
-
工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是 。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为 。
-
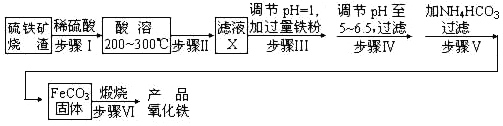
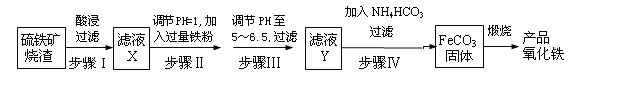
工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______(填离子符号)。
(2)步骤Ⅲ中可选用____(填字母)调节溶液的pH。
A.稀硝酸 B.氨水
C.氢氧化钠溶液 D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是____________
(4)步骤Ⅳ的反应温度一般需控制在35 ℃以下,其目的是__________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为__________________________。
-
(10分)工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)滤液X中含有的金属阳离子是____ ___(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填选项字母)。
A.稀硝酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是_________,_______。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为______________________。
-
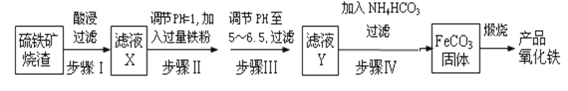
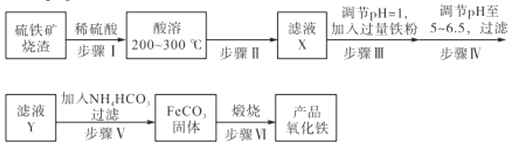
工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)实验室实现“步骤II”中分离操作所用的玻璃仪器有____、玻璃棒和烧杯等;该步骤是为了除去_______(填相关物质的化学式)。
(2)检验步骤III已经进行完全的操作是_______________________。
(3)步骤V的反应温度一般需控制在35℃以下,其目的是______________;该步骤中反应生成FeCO3的离子反应方程式为___________。
(4)步骤VI中发生反应的化学反应方程式为____________________。
(5)步骤V中,FeCO3达到沉淀溶解平衡时,若c(Fe2+)=1×10-6mol/L,欲使所得的FeCO3中不含有Fe(OH)2,应控制溶液的pH≤_____ (已知:Ksp[Fe(OH)2]=4.9×10-17,lg7=0.8)。
(6)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶” “水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为______。
-
工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
A.稀硫酸 B.氨水
C.氢氧化钠溶液 D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是______________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是__________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为_________________________。