-
化学与能源、环境、生产、生活密切相关。下列说法不正确的是
A.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
B.可利用工业生产产生的二氧化碳制造全降解塑料
C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
D.用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.CaH2的电子式:[H:]‑Ca2+[:H]-
B.Cl-的结构示意图:
C.质子数为92、中子数为146的U原子:
D.2,4,6-三硝基苯甲酸结构简式:
难度: 简单查看答案及解析
-
下列叙述正确的是
A.用乙醇或CCl4均可萃取碘水中的碘单质
B.CO2和SiO2晶体熔化时,克服粒子间作用力的类型相同
C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构
D.24Mg34S晶体中电子总数与中子总数之比为1∶1
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明的溶液中:Na+、K+、MnO4-、AlO2—
B.滴入酚酞呈无色的溶液中:K+、HCO3-、Cl-、CO32-
C.c(OH-)/c(H+)=1012的溶液中:SO32-、NH4+、NO3-、K+
D.c(I-)=0.1 mol·L-1的溶液中:Na+、NH4+、ClO-、SO42-
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA
B.常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA
C.5.6 g铁与一定量硝酸恰好反应,转移的电子数目一定为0.3NA
D.常温下,2 L 0.1 mol·L-1Na2CO3溶液中,含有的CO32-离子数为0.2NA
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B.硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O
C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O
D.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2—+4NH4++2H2O
难度: 简单查看答案及解析
-
向四支试管中分别加入少量不同的无色无味溶液进行如下操作,结论正确的是
操作
现象
结论
A
先加硝酸,再滴加BaCl2溶液
生成白色沉淀
原溶液中有SO42-
B
先加入H2O2溶液,再加KSCN溶液
生成血红色溶液
原溶液中有Fe3+原子
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
D
滴加稀NaOH溶液,加热,将湿润红色石蕊试纸置于试管口
试纸变蓝
原溶液中有NH4+
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为16。Y的原子半径比X 的大,X与W同主族,Z是地壳中含量最高的金属元素。下列说法正确的是
A. 原子半径的大小顺序: r(W)>r(Z)>r(Y)
B. 元素X、Y只能形成一种化合物
C. 元素W的简单气态氢化物的热稳定性比X的强
D. Y、W最高价氧化物所对应的水化物均能溶解Z的氢氧化物
难度: 简单查看答案及解析
-
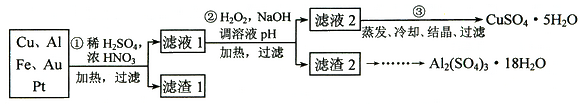
汞(熔点-39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞。目前工业上制粗汞的一种流程图如下。

下列分析错误的是
A.“灼烧辰砂法”过程中电子转移的方向和数目可表示为:
B.辰砂与氧化钙加热反应时,CaSO4为氧化产物
C.洗涤粗汞可用5%的盐酸代替5%的硝酸
D.减压蒸馏的目的是降低汞的沸点,提高分离效率
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
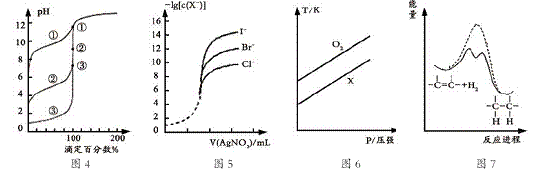
A. 用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C. 在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D. 由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
难度: 困难查看答案及解析
-
红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如下图所示。
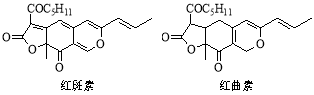
下列说法正确的是
A.红斑素和红曲素互为同分异构体
B.红斑素和红曲素都能与NaOH溶液反应
C.红斑素中含有醚键、羰基等三种含氧官能团
D.1 mol红曲素最多能与6 mol H2发生加成反应
难度: 简单查看答案及解析
-
下列实验操作能够达到实验目的的是
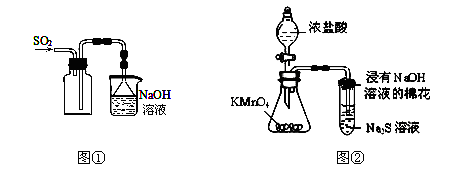
A. 实验室采用图①所示装置收集SO2
B. 可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱
C. 除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤
D. 称取0.40 g NaOH,置于100 mL容量瓶中,加水溶解,配制0.10 mol/L NaOH溶液
难度: 简单查看答案及解析
-
下列有关实验原理、方法和结论都正确的是
A.向苯酚钠溶液中通入少量CO2,产物为苯酚和Na2CO3
B.向蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀,说明浓硫酸具有脱水性和强氧化性
C.将溴丙烷与足量氢氧化钠溶液混合加热,冷却后加硝酸银溶液,可检验溴元素
D.分别测定0.5 mol·L-1 H3PO4和H2SO4溶液的pH,比较磷和硫元素非金属性的强弱
难度: 中等查看答案及解析
-
有Fe2++H++NO3-→Fe3++NH4++H2O这样一个变化过程,下列叙述不正确的是
A.氧化剂和还原剂的物质的量之比为1:8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO3-发生氧化反应,转移8 mol 电子
D.若把该反应设计为原电池,则负极反应为Fe2+-e- = Fe3+
难度: 中等查看答案及解析
-
如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
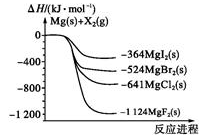
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2<MgBr2<MgCl2<MgF2
C.常温下氧化性:F2<Cl2<Br2<I2
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:
MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g),ΔH=-117kJ·mol-1
难度: 中等查看答案及解析


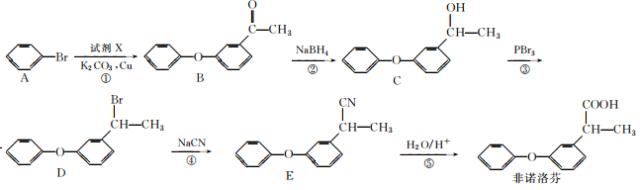
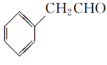 为原料制备
为原料制备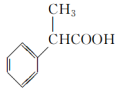 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。