-
对于0.1mol·L-1Na2SO3溶液,正确的是
A. 升高温度,溶液的pH降低
B. c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3)
C. c(Na+) + c(H+) = 2c(SO32―)+ 2c(HSO3―) + c(OH―)
D. 加入少量NaOH固体,c(SO32―)与c(Na+)均增大
难度: 中等查看答案及解析
-
能在溶液中大量共存的一组离子是
A. NH4+、Ag+、PO43-、Cl- B. Fe3+、H+、I-、 HCO3-
C. K+、 Na+、 NO3-、 MnO4- D. Al3+、Mg2+、SO42-、CO32-
难度: 中等查看答案及解析
-
在10℃时某化学反应速率为0.1mol/ (L·s),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol/(L·s),则该反应需在什么温度下进行
A. 30℃ B. 40℃ C. 50℃ D. 60℃
难度: 中等查看答案及解析
-
A. 由红变橙 B. 由黄变橙
C. 由黄变红 D. 由红变黄
难度: 简单查看答案及解析
-
相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 物质的溶解性为难溶,则该物质不溶于水
B. 不溶于水的物质溶解度为0
C. 绝对不溶解的物质是不存在的
D. 某离子被沉淀完全是指该离子在溶液中的浓度为0
难度: 简单查看答案及解析
-
关于电解NaCl水溶液,下列叙述正确的是
A. 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
B. 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C. 电解时在阳极得到氯气,在阴极得到金属钠
D. 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
难度: 简单查看答案及解析
-
下列变化的熵变大于零的是( )
A.H2O(l)→H2O(g) B.CO2(g)→CO2(s)
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O D.NH3(g)+HCl(g)=NH4Cl(s)
难度: 中等查看答案及解析
-
下面是关于中和滴定的实验叙述:取25 mL未知浓度的HCl溶液。在横线标明的操作中,有错误的是( )
a.放入锥形瓶中,此瓶需事先用蒸馏水洗净。 b.并将该瓶用待测液润洗过。
c.加入几滴酚酞作指示剂。 d.取一支酸式滴定管,经蒸馏水洗净。
e.直接往其中注入标准NaOH溶液,进行滴定。
f.一旦发现溶液由无色变成粉红色,即停止滴定 ,记下数据。
A. d、e、f B. b、d、e、f C. b、d、e D. b、c、e、f
难度: 简单查看答案及解析
-
已知在Ca3(PO4)2的饱和溶液中,c(Ca2+)=2.0×10-6mol.L-1,C(PO43-)=1.58×10-6mol.L-1,则Ca3(PO4)2的Ksp为( )
A. 2.0×10-29 B. 3.2×10-12 C. 6.3×10-18 D. 5.1×10-27
难度: 中等查看答案及解析
-
在室温下,等体积的酸和碱的溶液混合后,pH一定少于7的是
A. pH=3的HNO3跟pH=11的KOH B. pH=3的盐酸跟pH=11的氨水
C. pH=3硫酸跟pH=11的NaOH D. pH=3的醋酸跟pH=11的Ba(OH)2
难度: 简单查看答案及解析
-
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A. 反应混合物的浓度 B. 反应体系的压强
C. 正、逆反应的速率 D. 反应物的转化率
难度: 中等查看答案及解析
-
铜锌原电池(如图)工作时,下列叙述正确的是( )

A. 正极反应为:Zn-2e-=Zn2+
B. 盐桥中的K+移向ZnSO4溶液
C. 电池反应为:Zn+Cu2+=Zn2++Cu
D. 在外电路中,电子从负极流向正极;在电池内部,电子从正极流向负极
难度: 中等查看答案及解析
-
下列不是应用了电解池原理的是( )
A. 电镀 B. 工业制镁 C. 牺牲阳极的阴极保护法 D. 氯碱工业制Cl2等
难度: 中等查看答案及解析
-
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH+3O2+4OH-
2CO32-+6H2O,则下列说法错误的是
A. 放电时CH3OH参与反应的电极为正极
B. 充电时电解质溶液的pH逐渐增大
C. 放电时负极的电极反应式为:CH3OH-6e-+8OH-=CO32—+6H2O
D. 充电时每生成1 mol CH3OH转移6 mol电子
难度: 中等查看答案及解析
-
下列化学用语书写正确的是( )
A. 次氯酸的电离方程式:HClO===H++ClO-
B. 铝溶于烧碱溶液的离子方程式:Al+2OH-==AlO2-+H2↑
C. 电解精炼铜的阴极反应式:Cu-2e-==Cu2+
D. 已知中和热为57.3 kJ·mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH(aq)==Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是( )
A. 对熟石灰的悬浊液加热,悬浊液中固体质量增加
B. 实验室中常用排饱和食盐水的方式收集氯气
C. 打开汽水瓶,有气泡从溶液中冒出
D. 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
难度: 中等查看答案及解析
-
0.1 mol/L K2CO3溶液中,若使c(CO32-)更接近0.1 mol/L,可采取的措施是( )
A. 加入少量盐酸 B. 加KOH固体 C. 加水 D. 加热
难度: 中等查看答案及解析
-
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为( )
A. c (CH3COO-)>c (Na+) B. c (OH-)>c (H+)
C. c (CH3COOH)>c (CH3COO-) D. c (CH3COOH)+c (CH3COO-) >0.01mol/L
难度: 中等查看答案及解析
-
相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
A. 仍相同 B. 醋酸溶液的大 C. 盐酸的大 D. 无法判断
难度: 中等查看答案及解析
-
25℃时,将 0.10 mol•L-1的NaOH溶液逐滴滴入到20.00 mL 0.10 mol• L-1醋酸溶液中,溶液中的pH曲线与NaOH溶液体积的关系如图所示:
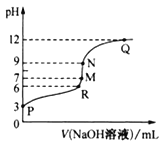
下列有关判断错误的是( )
A. 该温度下,醋酸的Ka的数量级为l0-5 B. N点对应的NaOH溶液体积可能为20.0mL
C. 溶液中,水的电离程度N点比Q点大 D. R点所示溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e-=4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
难度: 中等查看答案及解析
-
下列溶液加热蒸干后,能析出溶质固体的是( )
A. AlCl3 B. KHCO3 C. NH4HCO3 D. Fe2(SO4)3
难度: 中等查看答案及解析

