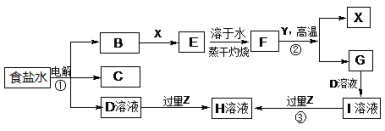
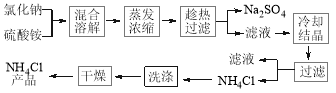
-
下列有关氧化还原反应的叙述正确的是
A.在一定条件下能发生反应:3O2=2O3,该反应不属于氧化还原反应
B.氧化反应一定先于还原反应发生
C.氧化性强的物质与还原性强的物质接触一定能发生反应
D.氧化剂本身一定只发生还原反应
难度: 中等查看答案及解析
-
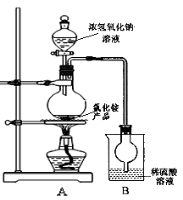
安全是顺利进行实验及避免伤害的保障。下列实验操作正确且不是从实验安全角度考虑的是
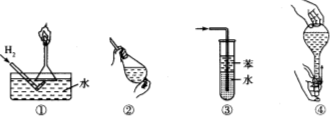
A.操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B.操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C.操作③:吸收氨气或氯化氢气体并防止倒吸
D.操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
难度: 中等查看答案及解析
-
下列有关物质的性质、应用等的说法中正确的是
A.浓硫酸久置于空气中体积不会变化
B.二氧化硫具有漂白性,与氯水混合使用效果更好
C.合金的熔点可以低于它的成分金属
D.Fe(OH)3胶体的本质特征是能产生丁达尔效应
难度: 中等查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO
B.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
C.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO
D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+
难度: 中等查看答案及解析
-
下列叙述正确的是(NA为阿伏加德罗常数的值)
A.1 mol Na2O·SiO2中含有NA个Na2O
B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约22.4 L,质量为28 g
D.4.6 g Na与适量氧气完全反应生成Na2O、Na2O2的混合物中含有的阴离子数大于0.1NA
难度: 中等查看答案及解析
-
配制250 mL 0.5 mol·L-1的NaOH溶液,在下列仪器中:①量筒 ②250 mL容量瓶 ③托盘天平和砝码 ④500 mL容量瓶 ⑤烧杯 ⑥玻璃棒 ⑦漏斗 ⑧药匙 ⑨胶头滴管
⑩250 mL的烧瓶,需要用到的仪器按使用先后顺序排列正确的是
A.⑧③⑤⑥②⑨ B.②③⑦⑤⑥
C.②⑤⑦⑥① D.④③⑦⑤⑥
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Cu(OH)2中加入硫酸:OH- + H+ = H2O
B.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3+ + 3SO42-+ 3Ba2+ + 6OH- = 2Al(OH)3↓ + 3BaSO4↓
C.钠加入水中:Na + 2H2O = Na+ + 2OH- + H2↑
D.向浓盐酸中加二氧化锰:MnO2+ 4H+ + 2Cl-
Mn2+ + 2H2O + Cl2↑
难度: 中等查看答案及解析
-
下列现象或性质能体现钠的物理性质的是
①钠燃烧时发出黄色的火焰 ②钠燃烧时生成过氧化钠 ③熔点低 ④密度比水⑤热和电的良导体 ⑥钠有很强的还原性
A.①③④⑤⑥ B.①②③④⑤ C.②③④⑤ D. ①③④⑤
难度: 中等查看答案及解析
-
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
A.2Na2O2+2H2O =4NaOH+O2↑ B.Cl2 + H2O
HClO + HCl
C.2F2+2H2O=4HF+O2 D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
难度: 中等查看答案及解析
-
同温同压下,等质量的O2 和O3 相比较,下列结论正确的是
A.它们的分子数目之比是 1∶1 B.它们的密度之比为 2∶3
C.它们的体积之比是 1∶1 D.它们的氧原子数目之比为 2∶3
难度: 中等查看答案及解析
-
M(NO3)2热分解化学方程式为:2M(NO3)2
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是
A. 24g/mol B.74g/mol C.148g/mol D.40g/mol
难度: 中等查看答案及解析
-
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
A.Cu2+、H+、Cl- B.K+、OH-、CO32-
C.CO32-、OH-、Cl- D.K+、H+、Cl-
难度: 中等查看答案及解析
-
将3.9 g镁铝合金,投入到500 mL 2 mol/L的盐酸中,合金完全溶解,再加入5 mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是
A.100 mL B.150 mL C.200 mL D.250 mL
难度: 中等查看答案及解析
-
将2.5g Na2CO3、NaHCO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是

A.OA段发生反应的离子方程式为H++OH-=H2O CO32-+H+=HCO3-
B.A点溶液中的溶质为NaC1、NaHCO3
C.混合物中NaOH的质量0.6g
D.当加入35mL盐酸时,产生CO2的体积为336mL
难度: 中等查看答案及解析
-
某澄清溶液可能含有K+、Al3+、Mg2+、NH4+、Fe2+、SO42-、CO32-中的一种或几种,为确定其成分,进行如下实验:①取部分溶液,逐滴滴入用HCl酸化的BaCl2溶液,只产生白色沉淀;②另取部分溶液,缓慢加入足量的Na2O2固体并加热,产生无色无味的气体,同时产生白色沉淀后白色沉淀部分溶解。下列推断正确的是
A.肯定有Al3+、SO42-,可能有K+、NH4+
B.肯定无NH4+、Mg2+、CO32-,可能有Fe2+
C.原溶液一定是明矾和MgSO4的混合溶液
D.肯定有Mg2+,K+只能通过焰色反应才能确定
难度: 中等查看答案及解析