-
在半导体工业中有这样一句话:“从沙滩到用户”,其中一种工艺流程示意图如下:
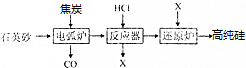
(1)焦炭的作用是 .
(2)已知反应器中的生成物有SiCl4、SiH2Cl2、SiH3Cl等,其中主产物的氯元素的质量百分含量为78.6%.则反应器中主要发生的化学反应方程式为 ,每生成 0.5molX,转移的电子物质的量为 mol.
(3)流程中可供循环使用的物质有 等(填化学式),它们也可以由 工业提供.
(4)以石英砂和 、 等为原料还可以制普通玻璃.
高一化学填空题困难题查看答案及解析
-
在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4 SiCl4+2H2=Si(纯)+4HCl。若在25℃101KPa条件下反应生成HCl气体49L(注:25℃101KPa条件下气体摩尔体积为24.5L/mol)则:
(1)反应生成HCl气体的质量为__________,转移电子的个数为_____________。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为 。
(3)“从沙滩到用户”涉及到多个反应,其中制取粗硅的反应方程式为 ,纯净的石英砂与烧碱反应可以制得水玻璃,反应的离子方程式为 。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O 13%,CaO 11.7%,SiO2 75.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需要上述原料的质量是 t(保留两位小数)。
高一化学填空题困难题查看答案及解析
-
在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(纯)+4HCl。
若在25℃、101kPa条件下反应生成HCl气体49L,(注:25℃、101kPa条件下气体摩尔体积为24.5L•mol-1)则:
(1)反应生成HCl气体的质量为__,转移电子的总数为___。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g•mL-1的盐酸,此盐酸的物质的量浓度为___。
(3)“从沙滩到用户”涉及多个反应,其中制取粗硅的反应方程式为___。纯净的石英与烧碱反应可以制得水玻璃,反应的离子方程式为__。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O13%,CaO11.7%,SiO275.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需耍上述原料的质量是___t。(保留两位小数)
高一化学计算题中等难度题查看答案及解析
-
半导体工业中,有一句行话:“从沙滩到用户”,即由SiO2制Si。制取过程中不涉及到的化学反应是( )
A. SiO2+2C
Si+2CO↑
B. SiO2+2NaOH=Na2SiO3+H2O
C. Si+2Cl2
SiCl4
D. SiCl4+2H2
Si+4HCl
高一化学单选题中等难度题查看答案及解析
-
半导体工业中,有一句行话:“从沙滩到用户”,即由SiO2制取Si。制取过程中不涉及的化学反应是( )
A.2C+SiO2
Si+2CO↑ B.SiO2+2NaOH=Na2SiO3+H2O
C.Si+2Cl2
SiCl4 D.SiCl4+2H2
Si+4HCl
高一化学单选题简单题查看答案及解析
-
半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是硅,下列有关硅及其化合物叙述正确的是( )
A. 水玻璃可做防火材料 B. 光导纤维的主要成分是高纯硅
C. 可用石英坩埚加热熔融氢氧化钠固体 D. 二氧化硅不和任何酸反应
高一化学单选题中等难度题查看答案及解析
-
半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是硅,下列有关硅及其化合物叙述正确的是( )
A. 水玻璃可做防火材料 B. 光导纤维的主要成分是高纯硅
C. 可用石英钳埚加热熔融氢氧化钠固体 D. 二氧化硅不和任何酸反应
高一化学单选题中等难度题查看答案及解析
-
晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:
石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
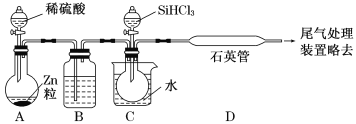
①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
高一化学综合题中等难度题查看答案及解析
-
晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:
石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
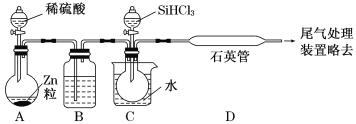
①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
高一化学综合题中等难度题查看答案及解析
-
晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:
石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
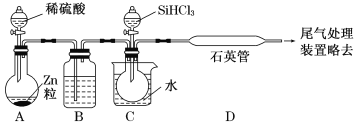
①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
高一化学综合题中等难度题查看答案及解析