-
下列说法不正确的是
A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性
B.常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关
C.石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化
D.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
难度: 中等查看答案及解析
-
下列制作铅笔的材料与相应工业不对应的是
A.橡皮擦——橡胶工业 B.铝合金片——冶金工业
C.铅笔芯——电镀工业 D.铅笔漆——涂料工业
难度: 简单查看答案及解析
-
已知咖啡酸的结构如图所示。关于咖啡酸的描述正确的是

A.分子式为C9H5O4
B.1mol咖啡酸最多可与5mol氢气发生加成反应
C.与溴水既能发生取代反应,又能发生加成反应
D.能与Na2CO3溶液反应,但不能与NaHCO3溶液反应
难度: 中等查看答案及解析
-
某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
离子方程式2Ca2+ + 3HCO3– + 3OH– = 2CaCO3↓ + CO32– + 3H2O可以表示
①Ca(HCO3)2与NaOH溶液反应
②NaHCO3与澄清石灰水反应
③Ca(HCO3)2与澄清石灰水反应
④NH4HCO3与澄清石灰水反应
A.①②③④ B.①②③ C.①②④ D.①②
难度: 中等查看答案及解析
-
将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是

A.分子式为C3H2O3
B.分子中含6个σ键
C.分子中只有极性键
D.8.6g该物质完全燃烧得到6.72LCO2
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
A.原子最外层电子数由多到少的顺序:Y、X、W、Z
B.原子半径由大到小的顺序:W、Z、Y、X
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
难度: 中等查看答案及解析
-
用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
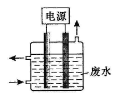
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
难度: 中等查看答案及解析
-
某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是
A.AlCl3 B.Na2O C.FeCl2 D.SiO2
难度: 中等查看答案及解析
-
下列物质见光不会分解的是
A.HClO B.NH4Cl C.HNO3 D.AgNO3
难度: 中等查看答案及解析
-
纯净物X、Y、Z转化关系如图所示,下列判断正确的是

A.Y不可能是氢气
B.X可能是金属铜
C.Z可能是氯化钠
D.Z可能是三氧化硫
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
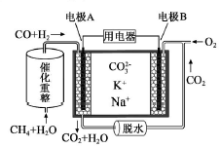
A.反应CH4+H2O
3H2+CO,每消耗1molCH4转移12mol e-
B.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
C.电池工作时,CO32-向电极B移动
D.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
难度: 中等查看答案及解析
-
下列操作或装置能达到实验目的的是

难度: 中等查看答案及解析
-
已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11。下列说法正确的是
A.25℃时,在CaCO3悬浊液中加入NaF固体,CaCO3全部溶解
B.25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,前者Ca2+浓度大
C.25℃时,CaCO3固体在盐酸中的Ksp比在氨水中的Ksp大
D.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,不会析出CaF2固体
难度: 中等查看答案及解析
-
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。下列叙述正确的是
A.上述反应中硫元素只被氧化
B.Na2S2O3在强酸性环境中能稳定存在
C.每生成1 molNa2S2O3,转移电子数为4NA
D.若将Na2CO3换成Na2SO3(配比不变),每吸收3 molSO2,理论上就会生成474 g Na2S2O3
难度: 中等查看答案及解析