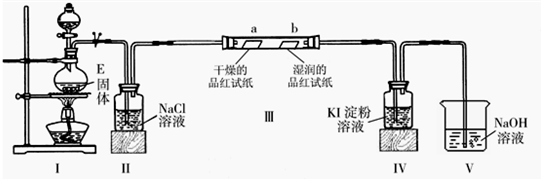
-
分类方法在化学教材必修I中出现,下列分类标准合理的是( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据反应中的热效应将化学反应分为放热反应和吸热反应.
A.①②
B.②④
C.①③
D.③④难度: 中等查看答案及解析
-
16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
A.16O2与18O2互为同分异构体
B.16O2与18O2核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子难度: 中等查看答案及解析
-
下列有关表述正确的是( )
A.H、D、T互为同素异形体
B.氨气分子构型为正四面体形
C.NH4Cl的电子式为
D.S2-的结构示意图为: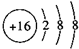
难度: 中等查看答案及解析
-
根据下列实验内容得出的结论正确的是
选项 实验内容 结论 A 某物质的水溶液使红色石蕊试纸变蓝 该物质一定是碱 B 某气体能使湿润淀粉碘化钾试纸变蓝 该气体一定是氯气 C 某物质的水溶液中加入盐酸产生无色无味气体 该溶液一定是碳酸根离子 D 0.84g铁和50.00mL 1.00mo l/L的稀硝酸反应 反应后溶液中一定有Fe3+和Fe2+
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列指定粒子的数目相等的是( )
A.物质的量相等的水与重水含有的中子数
B.等质量的乙烯和丙烯中含有共用电子对数
C.同温、同压、同体积的一氧化碳和乙烯含有的质子数
D.等物质的量和铁和铜分别与氯气完全反应,转移的电子数难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O
+O2+xOH-═Fe3O4+S4O
+2H2O下列说法中,正确的是( )
A.每生成1mol Fe3O4,反应转移的电子总数为3mol
B.Fe2+和S2O都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为mol
D.x=6难度: 中等查看答案及解析
-
如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
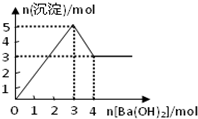
A.MgSO4
B.KAl(SO4)2
C.Al2(SO4)3
D.NaAlO2难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
B.冰岛和印度尼西亚火山喷发,火山灰在空气中几周都不能沉降,可能与胶体的性质有关
C.赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色
D.盛放NaOH溶液的试剂瓶不能用胶塞,应该用玻璃塞难度: 中等查看答案及解析
-
下列叙述正确的是.
A.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物.
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳.
D.一定条件下,浓醋酸在稀释过程中导电能力逐渐减弱.难度: 中等查看答案及解析
-
下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是( )
A.Ca2+、Fe2+、NO3-、Cl-
B.Ba2+、Na+、I-、NO3-
C.Na+、K+、SO42-、SO32-
D.K+、Mg2+、HCO3-、PO43-难度: 中等查看答案及解析
-
向100mL0.25mol/L的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )
A.3.45g
B.2.3g
C.1.15g
D.0.575g难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1.下列叙述正确的是( )
A.1L0.1mol/L的FeCl3溶液中,Fe3+的数目约为6.02×1022
B.7.8gNa2O2中含有的阴离子数目约为6.02×1022
C.1mol金刚石中含有C-C键的数目约为6.02×1023
D.标准状况下,1L甲醇完全燃烧后生成的CO2分子个数约为(1/22.4)×6.02×1022难度: 中等查看答案及解析
-
下列说法正确的是( )
A.非金属元素组成的化合物一定是共价化合物
B.离子化合物的熔点一定比共价化合物的高
C.元素周期律是元素的性质随元素相对原子质量的递增发生周期性递变的规律
D.含有阴离子的化合物一定含有阳离子难度: 中等查看答案及解析
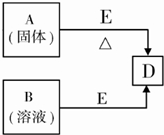 则:
则: