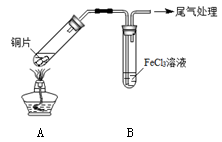
-
下列变化必须加入氧化剂才能实现的是
A.Cr2O72-→CrO42- B.HNO3 →NO2
C.SiO2 →Si D.CH3CH2OH→CH3CHO
难度: 中等查看答案及解析
-
下列与金属腐蚀有关的说法中,不正确的是
A.钢铁在潮湿空气中生锈属于电化学腐蚀
B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀
C.金属腐蚀的本质是金属原子失去电子被氧化的过程
D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应
难度: 简单查看答案及解析
-
下列关于材料的说法中,正确的是
A.光导纤维是信息社会必不可少的有机合成材料
B.棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水
C.航天飞机上的陶瓷防护片属于新型无机非金属材料
D.食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯
难度: 简单查看答案及解析
-
下列说法正确的是
A.2-甲基丙烷的一氯取代物有两种
B.
和
互为同系物
C.顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同
D.
的名称为2-甲基-3-乙基丁烷
难度: 简单查看答案及解析
-
下列事实对应的化学用语正确的是
A.金属钠加入滴有酚酞的水中,溶液变红:Na+ 2H2O=Na+ + 2OH- + H2↑
B.用NaOH溶液吸收多余的氯气:Cl2 + 2OH- =Cl- + ClO-+ H2O
C.将NaHCO3溶液和过量Ca(OH)2溶液混合有白色沉淀:2HCO3-+Ca2++2OH-=CaCO3↓+ 2H2O + CO32-
D.将醋酸溶液滴到大理石上有气泡产生:2H+ + CaCO3=CO2↑+ Ca2+ + H2O
难度: 中等查看答案及解析
-
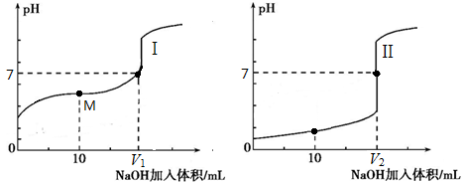
关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A.溶质水解反应:HCO3- +H2O
H3O++CO32-
B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C.微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
难度: 中等查看答案及解析
-
N2(g)+3H2(g)
2NH3(g)△H<0。当反应达到平衡时,下列措施能提高N2转化率的是
① 降温② 恒压通入惰性气体③ 增加N2的浓度④ 加压
A.①④ B.①② C.②③ D.③④
难度: 简单查看答案及解析
-
下列有关实验叙述正确的是
A.除去苯中混有的苯酚可加入浓溴水后过滤
B.向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液褪色,说明维生素C有还原性
C.向淀粉溶液中滴加稀硫酸后,加热,再加入新制Cu(OH)2加热,没有出现红色沉淀,说明淀粉没有发生水解反应
D.向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应
难度: 中等查看答案及解析
-
有机物X完全燃烧的产物只有二氧化碳和水,元素组成分析发现,该物质中碳元素的质量分数为60.00%,氢元素的质量分数为13.33%,它的核磁共振氢谱有4组明显的吸收峰。下列关于有机物X的说法不正确的是
A.含有C、H、O三种元素 B.相对分子质量为60
C.分子组成为C3H8O D.结构简式为CH3CHOHCH3
难度: 中等查看答案及解析
-
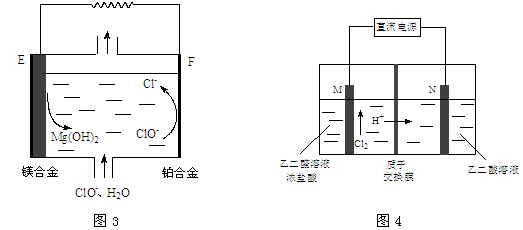
关于下列装置的说法正确的是
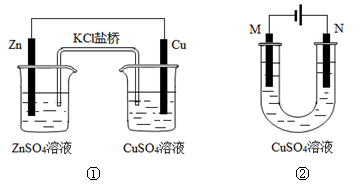
A.装置①中盐桥内的K+移向CuSO4溶液
B.装置①将电能转变为化学能
C.若装置②用于铁棒镀铜,则N极为铁棒
D.若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变
难度: 简单查看答案及解析
-
室温下,下列有关两种溶液的说法不正确的是
序号
①
②
pH
12
12
溶液
氨水
氢氧化钠溶液
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
难度: 中等查看答案及解析
-
工业上常用氯氧化法处理含氰(CN-)废水,一定条件下,氯气和CN-反应生成无毒气体。下列说法不正确的是
A.CN-中碳元素的化合价为+2
B.该反应的产物之一是无毒的N2
C.当1 molCN-参与反应时,转移3 mol e-
D.处理含0.1 mol CN-的废水,理论上需要消耗标准状况下Cl2的体积为5.6L
难度: 中等查看答案及解析
-
下述实验方案能达到实验目的的是
编号
A
B
C
D
实验
方案
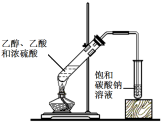

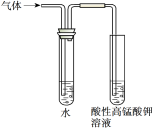
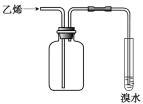
实验
目的
实验室制备乙酸乙酯
分离乙酸和水
验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯
收集乙烯并验证它与溴水发生加成反应
难度: 中等查看答案及解析
-
工业上用CO和H2合成CH3OH:CO(g)+2H2(g)
CH3OH(g)。反应的平衡常数如下表:
温度/℃
0
100
200
300
400
平衡常数
667
13
1.9×10-2
2.4×10-4
1×10-5
下列说法正确的是
A.该反应的△H> 0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用5 ×103 kPa和250℃的条件,其原因是原料气的转化率高
D.t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
难度: 中等查看答案及解析