-
下列有关说法不正确的是( )
A. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B. 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
C. 李白诗句“炉火照天地,红星乱紫烟”,“紫烟”指“炉”中碘升华的现象
D. 曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
难度: 简单查看答案及解析
-
化学与社会生产生活紧密相关,下列说法正确的是( )
A. 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用
B. 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 高纯度的SiO2可以制成光电池,将光能直接转化为电能
难度: 简单查看答案及解析
-
下列有关有机物的结构和性质的叙述中正确的是
A.
、
、
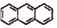 互为同系物
互为同系物B. 丙烯和苯分子所有原子均在同一平面内
C. 乙烯和聚乙烯均可使酸性高锰酸钾溶液褪色
D. 有机物M分子式为C6H12O2且能与NaHCO3溶液反应产生CO2,其同分异构体有8种
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是( )
A. lmolC3H8O分子中含有共价键数目为11NA
B. 15 g 14C16O中含有的质子数目为8NA
C. 标准状况下,22.4LSO2和SO3的混合物,含硫原子的数目为NA
D. 一定条件下,将2.8gN2与足量氢气充分反应,得到氨气分子数目等于0.2NA
难度: 简单查看答案及解析
-
下列关于离子共存或离子反应的说法正确的是( )
A. pH=1的溶液中能大量存在:MnO4—、K+、Na+、S2O32—
B. 含Fe3+的溶液中:CO32—、NO3—、HCO3—、Na+
C. 将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO3—+NH4+
D. 用KIO3氧化酸性溶液中的KI:5I-+IO3—+3H2O===3I2+6OH-
难度: 简单查看答案及解析
-
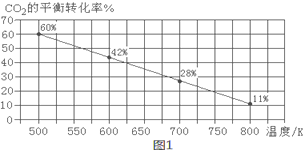
CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是
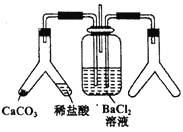
A. Cu和浓硝酸 B. CaO和浓氮水 C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
难度: 中等查看答案及解析
-
下列叙述正确的有 ( )
①碱性氧化物:Na2O2、MgO、Al2O3
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2反应、Ba(OH)2·8H2O与NH4Cl反应均既是氧化还原反应,又是吸热反应
⑤碱石灰、生石灰、玻璃、漂白粉、光导纤维都是混合物
⑥苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质
A. 1个 B. 2个
C. 3个 D. 4个
难度: 简单查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是

A. 用标准氢氧化钠溶液滴定未知浓度的盐酸
B. 加热FeCl3溶液获取FeCl3固体
C. 用酒精萃取碘水中的碘
D. 通过原电池原理证明金属性Zn>Cu
难度: 困难查看答案及解析
-
根据下列实验操作和现象,所得结论不正确的是( )
选项
实验
现象
结论
A
向AgNO3溶液中滴加过量氨水
得到澄清溶液
Ag+与NH3·H2O
能大量共存
B
Ba(NO3)2溶液中通入SO2气体
产生白色沉淀
BaSO4难溶
C
向KMnO4酸性溶液中滴加草酸
溶液褪色
草酸具有还原性
D
用蒸馏水将Na2SO3固体样品溶解,
加入足量稀盐酸酸化,再加入氯化钡溶液
产生白色沉淀
Na2SO3样品己变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质,甲、乙、丙均含有相同的某种元素,它们之间有如图转化关系; 下列有关物质的推断不正确的是 ( )
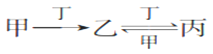
A. 若甲为焦炭,则丁可能是氧气
B. 若甲为NaAlO2,则丁可能是盐酸
C. 若甲为Fe,则丁可能是C12
D. 若甲为NaOH溶液,则丁可能是CO2
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期主族元素。W的原子半径是周期表中最小的;X2—与Y+的电子层结构相同;Z的最高正价与最低负价的代数和为4,下列说法正确的是 ( )
A. 原子半径:Z<Y<X
B. 最简单氢化物的稳定性:X<Z
C. X与Y形成的化合物中,阴阳离子个数比为1:2
D. Z的低价氧化物与X的氢化物反应,一定生成弱酸
难度: 简单查看答案及解析
-
已知常温下二氯化二硫(S2 Cl2)为红棕色液体,其结构式为Cl-S-S-Cl。其制备反应及与水反应的化学方程式如下:①CS2+3Cl2
 CCl4+S2Cl2 ②2S2Cl2 +2H2O=4HCl+SO2↑+3S↓则下列说法正确的是 ( )
CCl4+S2Cl2 ②2S2Cl2 +2H2O=4HCl+SO2↑+3S↓则下列说法正确的是 ( )A. 反应①中CS2作氧化剂
B. 反应②中S2Cl2既作氧化剂又作还原剂
C. 反应①中每生成1mol S2Cl2转移4mol电子
D. 反应②中氧化产物与还原产物的物质的量之比为3:1
难度: 简单查看答案及解析
-
近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是( )

A. 石墨极发生的反应是2H2O+2e— === H2↑+2OH—
B. 有机电解质和水溶液不可以互换区域
C. 该装置不仅可提供电能,还可得到清洁的氢气
D. 标准状况下产生22.4 L的氢气时,正极消耗锂的质量为14 g
难度: 简单查看答案及解析
-
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是( )
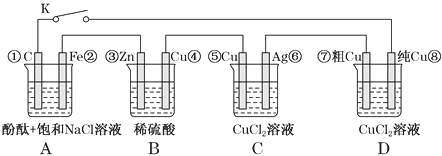
A. 当K断开时,B装置锌片溶解,有氢气产生
B. 当K闭合时,A装置发生吸氧腐蚀,在电路中作电源
C. 当K闭合后,C装置可作为电镀池装置
D. 当K闭合后,A、B装置中pH变大,C、D装置中pH不变
难度: 困难查看答案及解析
-
水溶液X中只可能含有K+、Mg2+、Al3+、AlO2—、SiO32—、SO32—、CO32—、SO42—中的若干种离子。某同学对该溶液X进行了如下实验;下列判断正确的是( )
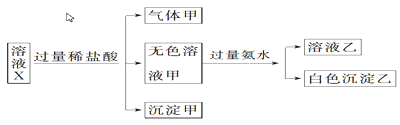
A. 气体甲一定是纯净物
B. K+、AlO2—和SiO32—一定存在于溶液X中
C. 沉淀甲是硅酸和硅酸镁的混合物
D. 凭以上实验能确定SO42—是否存在于溶液X中
难度: 中等查看答案及解析
-
合成氨及其相关工业中,部分物质间的转化关系如下:
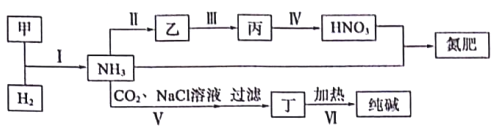
下列说法正确的是
A. 反应I、Ⅱ、Ⅲ、V均属于氧化还原反应
B. 甲、乙、丙和丁四种物质中都含有氮元素
C. 反应Ⅳ和Ⅵ中的部分产物可在上述流程中循环利用
D. 反应V是先向饱和氯化钠溶液中通CO2至饱和再通NH3
难度: 中等查看答案及解析