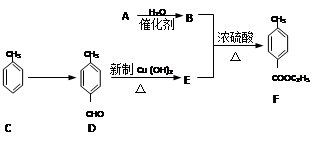-
化学与社会、生产、生活密切相关。下列做法值得提倡的是
A.SO2作为食品漂白剂 B.氟里昂作为制冷剂
C.Na2CO3治疗胃酸过多 D.“地沟油”制取肥皂
难度: 简单查看答案及解析
-
下列物质不能通过置换反应得到的是
A.CO B.F2 C.C D.Fe3O4
难度: 中等查看答案及解析
-
重水
是重要的核工业原料,下列关于D原子的说法错误的是
A.氘
原子核外有1个电子 B.是H的同位素
C.自然界中没有D原子存在 D.
质量数为2
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.只含有金属元素的离子不一定是阳离子
B.金属阳离子被还原不一定得到金属单质
C.氧化还原反应中,非金属单质必是氧化剂
D.元素从化合态变为游离态时,一定被还原
难度: 中等查看答案及解析
-
一定温度下,满足下列条件的溶液一定呈酸性的是
A.pH
的某物质的水溶液 B.加酚酞后显无色的溶液
C.能与金属Al反应放出H2的溶液 D.
的任意物质的水溶液
难度: 中等查看答案及解析
-
下列化学工业中,未涉及原料循环使用的是
A.侯德榜制碱法 B.索尔维制碱法
C.工业电解饱和食盐水 D.工业炼铁
难度: 中等查看答案及解析
-
已知:甲
乙
丙
丁,其中丁为强酸,则甲不可能为
A.N2 B.C C.S D.NH3
难度: 中等查看答案及解析
-
下列分子中,属于含有极性键的非极性分子的是
A.PCl3 B.H2S C.P4 D.C2H4
难度: 中等查看答案及解析
-
下列关于实验操作的叙述正确的是
A.酸碱滴定时,眼睛一定要注视滴定管中液面的变化
B.实验室制乙烯时,为使受热均匀,应轻轻搅动温度计
C.纸上层析实验中,须将滤纸上的试样点浸入展开剂中
D.分液时,下层液体先从分液漏斗下口放出,上层液体后从上口倒出
难度: 中等查看答案及解析
-
已知
。下列说法或表达正确的是
A.使用催化剂可改变该反应的反应热
B.
;
C.A和
混合气体的稳定性比C气体强
D.该条件下,2LC气体分解成2LA气体与1LB气体吸收的热量为Q
难度: 中等查看答案及解析
-
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种:

下列说法正确的是
A.
属于芳香烃
B.
与BHT互为同系物
C.BHT久置于空气中不会被氧化
D.两种方法的反应类型都是加成反应
难度: 中等查看答案及解析
-
如图用石墨电极电解CuCl2溶液。下列分析正确的是( )
A.a极发生还原反应
B.每生成6.4 g Cu,转移电子0.2 mol
C.阳极反应式:
D.在直流电源中电流从b流向a
难度: 中等查看答案及解析
-
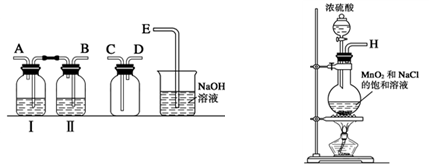
用下列装置不能达到实验目的的是

A.用甲图装置比较NaHCO3和Na2CO3的热稳定性
B.用乙图装置制备
C.用丙图装置制备并收集少量NO2气体
D.用丁图装置制取少量金属锰
难度: 中等查看答案及解析
-
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)
2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
A.当容器内密度保持不变时,可以判断反应已达平衡
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
难度: 中等查看答案及解析
-
下列实验中,依据实验操作及现象,得出的结论正确的是
操作 现 象 结 论
A. 测定等浓度的Na2CO3和Na2SO3 溶液的pH 前者pH比后者的大 非金属性:
B. 无色溶液中滴加氯水和CCl4,
振荡、静置 下层溶液显紫色 原溶液中有
C. 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 生成白色沉淀 溶液X中一定含有
或
D. 向某无色溶液中滴加硝酸酸化的BaCl2溶液 产生白色沉淀 溶液中一定含有
难度: 中等查看答案及解析
-
恒温下使某盐溶液蒸发掉ag水,有bg不含结晶水的晶体析出,再蒸发掉ag水后,又有cg不含结晶水的晶体析出,则原溶液中溶质的质量分数为
A.
B.
C.
D.无法确定
难度: 中等查看答案及解析
-
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为
g。下列说法不正确的是
A.镁铝合金与盐酸反应转移电子总数为
B.
C.沉淀是
和
的混合物
D.1.2>a>0.9
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,22.4 L甲苯中含
键数目为8 NA
B.常温常压下,7.8 g苯中含有双键的数目为0.3 NA
C.苯和苯甲酸的混合物1 mol,完全燃烧消耗O2的分子数为7.5 NA
D.常温常压下,5.2 g苯和苯乙烯的混合物中含有原子数目为0.8 NA
难度: 中等查看答案及解析
-
下列实验过程中产生的现象与所给图形相符合的是( )
A.往乙酸中通入氨气
B.往
溶液中滴加硫酸
C.往氢硫酸溶液中通入氯气
D.往NaOH溶液中通入过量CO2
难度: 中等查看答案及解析
-
下列除杂分离方法正确的是
选项 物质 杂质 所用试剂 分离方法
A. KCl CaCl2 Na2CO3溶液、盐酸 过滤
B. CH3CH2OH CH3COOH CaO 蒸馏
C. NaCl NH4Cl NaOH 蒸干
D. N2 O2 铜网 加热
难度: 中等查看答案及解析
-
常温下,向20.00mL 0.1000 mol
(NH4)2 SO4溶液中逐滴加入0.2000 mol
NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
下列说法正确的是
A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO42)>c(NH3·H2O )>c(OH-)>c(NH4+)
难度: 困难查看答案及解析
-
0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为
和
,同
时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
A.30 B.46 C.50 D.66
难度: 中等查看答案及解析