-
我国节能减排“十二五规划”要求到2015年,全国二氧化硫排放总量控制在2086.4万吨,若能回收二氧化碳,其对工农业生产中有重要的作用。下列关于干冰(右图)的说法正确的是

A.干冰是弱电解质
B.干冰可以灭火
C.氧碳两种元素只能组成二氧化碳
D.干冰在常温常压下稳定存在
难度: 简单查看答案及解析
-
下列关子化学用语的表示正确的是
A.质子数为94、中子数为144的钚(Pu)原子:14494Pu
B.H2O2的电子式:
C.S2-离子结构示意图:
D.
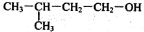 的名称2-甲基-4-丁醇
的名称2-甲基-4-丁醇难度: 简单查看答案及解析
-
下列说法正确的是
A.乙烯分子与苯分子中碳碳键相同
B.生成物总能量一定低于反应物总能量
C.置换反应一定属于氧化还原反应
D.通过化学变化可以直接将水转变为汽油
难度: 简单查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学健的过程。反应过程的示意图如下:
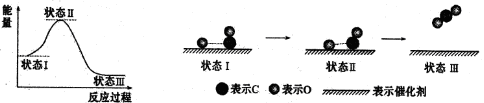
下列说法正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断健形成C和O
C.CO和O生成了具有极性共价健的CO2
D.状态I→状态III表示CO与O2反应的过程
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W原子序数依次增大,X原子最外层电子数是其电子层数的3倍,Y与X可形成Y2X2和Y2X两种离子化合物,Y、Z均是来自海水的活泼金属,X原子的核外最外层电子数是Z原子的最外层电子数的3倍,W与X同主族。下列说法正确的是
A.X分别与Y、Z形成的化合物中化学键类型完全相同
B.原子半径:Y<Z<W
C.气态氢化物的稳定性:X>W
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe3+、Cl-、NO3-、K+
B.滴入酚酞显红色的溶液中:Na+、Mg2+、A1O2-、NO3-
C.0.1 mol/L KMnO4溶液:Na+、Fe2+、SO42-、Cl-
D.含0.1mol/LKI的溶液:Fe3+、Na+、NO3-、C1-
难度: 中等查看答案及解析
-
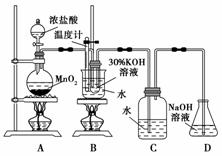
下列有关实验原理或操作正确的是
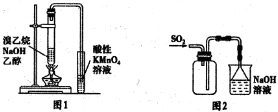
A.用图1所示装置检验有乙烯生成
B.用图2所示装置收集SO2
C.室温下,向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,以除去苯中少量的苯酚
D.酸碱中和滴定前,滴定管用蒸馏水洗涤后用待装溶液润洗
难度: 中等查看答案及解析
-
下列各组物质中,不满足表中图示物质在通常条件下一步转化关系的组合有
组别
X
Y
Z
W

A
Al
AlCl3
Al(OH)3
Al2O3
B
Na
NaOH
Na2CO3
NaCl
C
Cl2
Ca(ClO)2
HClO
HCl
D
Fe
FeCl3
FeCl2
Fe(OH)2
难度: 中等查看答案及解析
-
下列说法中用离子方程式表达正确的是
A.氯气溶于水:Cl2+H2O
H++Cl-+HClO
B.向NaAlO2溶液中通入过量CO2: 2AlO2- +CO2+3H2O=2A1 (OH)3↓+CO32-
C.Fe (NO3)2溶液中滴加少量稀盐酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O
D.用醋酸溶液除去水垢:2H+ + CaCO3 =Ca2++CO2 ↑+H2O
难度: 中等查看答案及解析
-
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
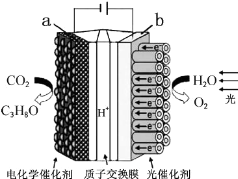
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1mol O2,有44g CO2被还原
D.a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
D.当H2O与Na2O2反应生成1molO2时,转移的电子数目为2×6.02×1023
难度: 中等查看答案及解析
-
CPAE是蜂胶的主要活性成分.其结构简式如图所示。下列说法正确的是
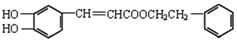
A.每个CPAE分子中含有1个手性碳原子
B.用FeCl3溶液可以检测CPAE
C.CPAE能发生取代、加成和消去反应
D.1moICPAE最多可与含2mol NaOH的溶液发生反应
难度: 中等查看答案及解析
-
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4•7H2O),设计了如下流程:
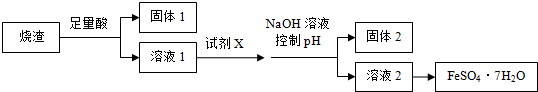
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O
难度: 困难查看答案及解析
-
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
A.在0.1 mol/LNa2S溶液中:c(Na+)>c(S2-)>c(HS-)>c(H+)>c(OH-)
B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.向0.1mol•L-1盐酸与0.1mol•L-1 K2CO3溶液等体积混合:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)
D.将0.1 mol•L-1Na2CO3溶液和0.1 mol•L-1NaHCO3溶液等体积混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)BC
难度: 困难查看答案及解析
-
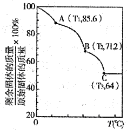
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
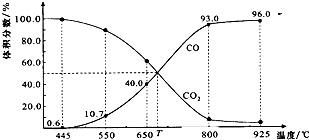
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
A.550℃时,若充入惰性气体,v正、v逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡不移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.p总
难度: 困难查看答案及解析
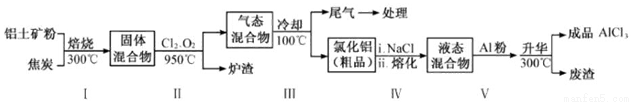
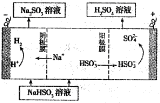
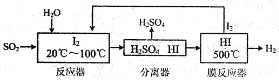
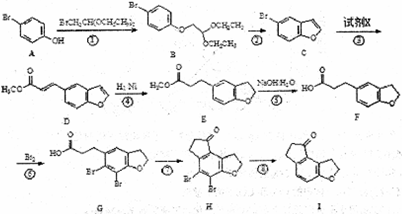
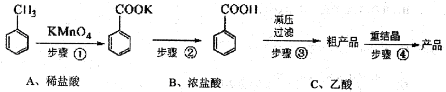
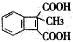 ,写出合成流程图(无机试剂任用).合成流程图示例如下:
,写出合成流程图(无机试剂任用).合成流程图示例如下: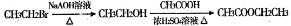 。
。