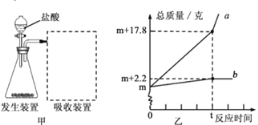
-
二氧化碳气体既是温室效应的元凶,又是一种潜在的碳资源。实验室里,科学家已成功利用二氧化碳与环氧丙烷(一种简单有机物)在催化剂的作用下合成“二氧化碳塑料”。该新型塑料在投入工业生产前,以下不是科学家重点考虑的问题是
A. 如何提高催化剂的催化效率 B. 新型塑料是否可降解
C. 新型塑料的化学性质是否稳定 D. 新型塑料生产是否影响碳循环
难度: 简单查看答案及解析
-
硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
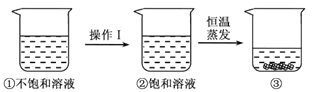
A. 操作I一定是降温 B. 操作I一定是加溶质
C. ①与③的溶质质量一定相等 D. ②与③的溶质质量分数一定相等
难度: 简单查看答案及解析
-
某同学在学习了金属及其化合物之间的转化规律后,给制了可以通过一步反应制取MgSO4的思维导图,其中所选用的物质错误的是
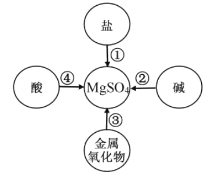
A. ①—Mg B. ②—MgCl2 C. ③—H2SO4 D. ④—Mg(OH)2
难度: 简单查看答案及解析
-
15%的H2O2溶液在二氧化锰催化作用下会剧烈反应产生O2.实验室欲利用15%的H2O2溶液制取O2,则下列装置中,仪器选择和药品放置最合理的是( )
A.
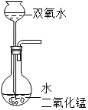 B.
B. 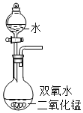 C.
C. 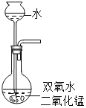 D.
D. 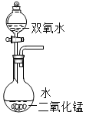
难度: 简单查看答案及解析

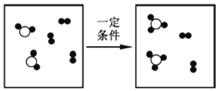
 _____________
_____________