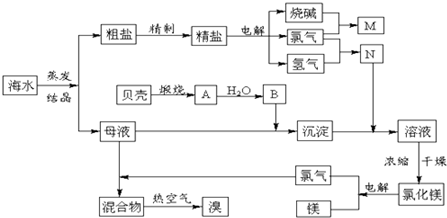
-
控制适合的条件,将反应2Fe3++2I-⇌2Fe2++I2设计成如右图所示的原电池.下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极难度: 中等查看答案及解析
-
下列说法不符合生产实际的是( )
A.硫酸生产中,SO2催化氧化选择1~10 MPa、400~500℃条件下进行
B.尾气中含有少量SO2,可用石灰水吸收,然后再用硫酸处理
C.工业上,常采用以铁为主的催化剂,在400~500℃和10~30 MPa的条件下合成氨
D.造气中产生的CO,可在催化剂作用下,与水蒸气反应生成CO2和H2难度: 中等查看答案及解析
-
某复合材料是由碳纤维为增强体、金属钛为基体复合而成的.估计这种材料( )
①耐高温 ②不耐热 ③导电、导热 ④不导电、不导热 ⑤可用于飞机机翼 ⑥可用于导弹的壳体.
A.①③⑤⑥
B.②③⑤⑥
C.②③④
D.③④⑤难度: 中等查看答案及解析
-
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4⇌2NO2△H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙,(b)甲>乙
B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙
D.(a)甲>乙,(b)甲<乙难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.Na2S溶液的水【解析】
S2-+2H2O⇌H2S+2OH-
B.NaHCO3溶液的电离:HCO3-+H2O⇌H2 CO3+OH-
C.NH4Cl溶液的水【解析】
NH4++H2O⇌NH3•H2O+H+
D.把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑难度: 中等查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )
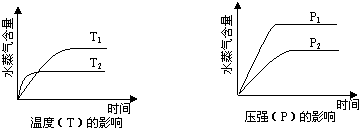
A.CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0
B.CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0
C.CH3CH2OH (g)⇌CH2=CH2(g)+H2O(g);△H>0
D.2C6H5CH2CH3(g)+O2(g)⇌2 C6H5CH=CH2(g)+2H2O(g);△H<0难度: 中等查看答案及解析
-
现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A.加入10mL 0.01mol•L-1的NaOH溶液
B.加入10mL 的水进行稀释
C.加水稀释成100mL
D.加入10mL 0.01mol•L-1的盐酸溶液难度: 中等查看答案及解析
-
下列各组离子,在指定环境中一定能大量共存的是( )
A.pH=7的溶液中:Al3+、K+、SO42-、HCO3-
B.能使pH试纸变深蓝色的溶液中:S2-、SO32-、Na+、SO42-
C.加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3-
D.由水电离出的c(OH-)=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl-难度: 中等查看答案及解析