-
2012年6月24日,“蛟龙号”下潜到深海7020米,创造了我国载人深潜新纪录。“蛟龙号”的耐压舱用钛合金制造。下列有关钛原子(
)的说法正确的是
A.质子数为48 B.原子序数为22
C.质量数为22 D.中子数为48
难度: 简单查看答案及解析
-
元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
-
在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是
A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料
C.制农药的材料 D.半导体材料
难度: 简单查看答案及解析
-
下列气体中,无色无味的是
A.Cl2 B.SO2 C.NO2 D.O2
难度: 简单查看答案及解析
-
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是
A.元素周期表有7个周期
B.元素周期表有18个族
C.第ⅠA族的元素全部是金属元素
D.短周期是指第1、2、3、4周期
难度: 简单查看答案及解析
-
在下列元素中,不属于主族元素的是
A.氢 B.铁 C.钙 D.氯
难度: 简单查看答案及解析
-
下列元素中,最高正化合价数值最大的是
A.Cl B.P C.Na D.Ar
难度: 简单查看答案及解析
-
下列物质含有离子键的是
A.Cl2 B.NaCl C.CO2 D.H2O
难度: 简单查看答案及解析
-
下列微粒中,核外电子数相同的是
①F– ②Na+ ③Ne ④K+ ⑤NH3
A.①②③④ B.①②④⑤ C.①②③⑤ D.②③④⑤
难度: 中等查看答案及解析
-
元素R的原子序数是15,下列关于R元素的说法中,错误的是
A.R的最高正化合价是+5
B.R是第2周期第ⅤA族的元素
C.R的氢化物分子式是RH3
D.R的最高价氧化物对应的水化物的水溶液呈酸性
难度: 中等查看答案及解析
-
银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪。制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了。“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是
A.硫的还原性 B.硫的漂白性
C.二氧化硫的还原性 D.二氧化硫的漂白性
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.NaCl的电子式:
B.氟原子的结构示意图:
C.中子数为20的氯原子: 1720Cl
D.碳酸钠的电离方程式:Na2CO3=2Na++CO32-
难度: 困难查看答案及解析
-
下列各组中化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl D.非金属性:F>O>S
难度: 困难查看答案及解析
-
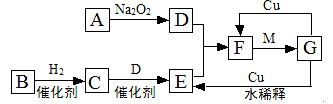
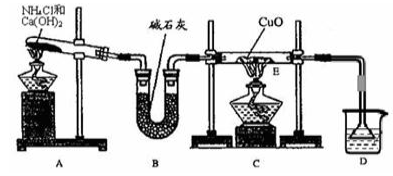
下列除去杂质的操作方法正确的是
A.NO中有少量的NO2:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C. N2中有少量的O2:通过足量灼热的氧化铜
D.硝酸中溶有少量NO2,可向硝酸中加入少量水,使NO2与水反应生成硝酸。
难度: 困难查看答案及解析
-
若aAn+与bB2-两种离子的核外电子层结构相同,则a的数值可表示为
A.b+n+2 B.b+n-2 C.b-n-2 D.b-n+2
难度: 中等查看答案及解析
-
常温下,将铜片投入到下列溶液中,会产生气体的是
A.稀硫酸 B.稀盐酸 C.浓硝酸 D.浓硫酸
难度: 中等查看答案及解析
-
实验是化学学习的基础。下列实验叙述正确的是
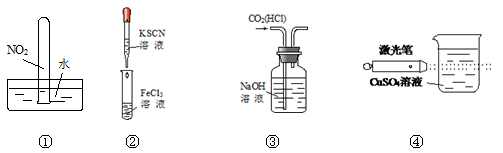
A.实验①试管最终会充满水
B.实验②试管中溶液变为血红色
C.可用实验③装置除去CO2气体中含有的少量HCl杂质
D.实验④检验硫酸铜溶液
难度: 困难查看答案及解析
-
下列关于浓硝酸的叙述正确的是
A.浓硝酸有氧化性,稀硝酸无氧化性
B.常温下能用铝制容器盛放浓硝酸
C.浓硝酸在常温下可迅速与铜片反应放出一氧化氮气体
D.浓硝酸不需要用棕色试剂瓶保存
难度: 简单查看答案及解析
-
某无色溶液中存在大量的NH4+、H+、NO3ˉ,该溶液中还可能大量存在的离子是
A.CO32ˉ B.OHˉ C.Fe2+ D.Al3+
难度: 中等查看答案及解析
-
下列化学或离子方程式正确的是
A.常温下,将铁片置于浓硝酸中:Fe+6HNO3(浓)==Fe(NO3)3+3NO2↑+3H2O
B.氢氧化铜与盐酸反应:H++OH–= H2O
C.利用腐蚀法制作印刷电路板:Fe3++Cu=Fe2++Cu2+
D.向浓硝酸中加入铜片:Cu+4H++4NO3–==Cu2++2NO2↑+2H2O
难度: 困难查看答案及解析
-
有氯化钡稀溶液甲乙两试管分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是
A.甲、乙两试管都有白色沉淀生成
B.甲、乙两试管都没有白色沉淀生成
C.甲试管没有白色沉淀生成而乙试管有
D.甲试管有白色沉淀生成而乙试管没有
难度: 困难查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
A.R的原子半径比Z的大
B.R的氢化物的热稳定性比W的强
C.X与Y形成的化合物只有一种
D.Y的最高价氧化物的水化物的酸性比W的强
难度: 极难查看答案及解析
-
把aL含硫酸铵、硝酸铵的溶液分成两等份,一份用b mol烧碱刚好把NH
转化为NH3,另一份与氯化钡溶液完全反应消耗c mol BaCl2。则原溶液中NO
的浓度为
A.
B.
C.
D.
难度: 困难查看答案及解析