-
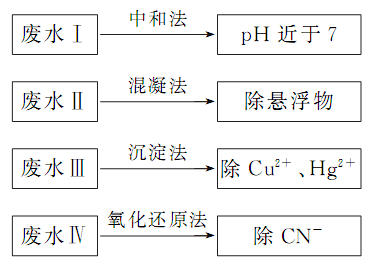
“碳捕捉和储存(CCS)技术”是指通过碳捕捉技术,将工业和有关能源产业所产生的二氧化碳分离出来再利用。当前,二氧化碳及其产品的开发、应用是很多科学家致力研究的课题。下列有关说法不正确的是 ( )
A.对捕捉到的二氧化碳进行净化,然后用于制造干冰
B.以捕捉到的二氧化碳为原料,用来制备甲醇等产品
C.用捕捉到的二氧化碳与海藻发生光合作用,可提高海藻产量
D.人类应将大气中的二氧化碳全部捕捉,以防产生温室效应
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A.直径介于1nm~100nm 之间的粒子称为胶体
B.气体甲通入溶液乙中溶液乙颜色褪去,说明气体甲一定具有漂白性
C.在海轮外壳上镶入锌块,可减缓船体的腐蚀速度
D.向氯化银悬浊液中滴入碘化钾溶液,有碘化银沉淀生成,说明氯化银的溶解度小于碘化银的溶解度
难度: 简单查看答案及解析
-
下列说法中不正确的是 ( )
A.聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物
B.高温能杀死流感病毒是因为构成病毒的蛋白质分子受热变性
C.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
D.煤经过气化和液化两种物理变化,可变为清洁能源
难度: 简单查看答案及解析
-
某同学对所学部分化学知识归纳如下,其中有错误的一组是 ( )
A
物质性质与用途
B
安全常识
N2 性质稳定———填充在食品袋防腐
乙醇具有可燃性———用作燃料
CO 具有还原性———冶炼金属
假酒中毒———由甲醇引起
假盐中毒———由黄曲霉毒素引起
瓦斯爆炸———由天然气引起
C
元素与人体健康
D
日常生活经验
缺铁———易引起贫血
缺钙———易得佝偻病或骨质疏松症
缺碘———易得甲状腺肿大
去除衣服上的油污———用汽油洗涤
热水瓶中的水垢———用食醋清除
使煤燃烧更旺———把煤做成蜂窝状
难度: 简单查看答案及解析
-
下列说法:①粗盐和酸雨都是混合物②沼气和水煤气都是可再生能源③冰和干冰既是纯净物又是化合物④钢铁和硬币都是合金⑤盐酸和食醋既是化合物又是酸⑥纯碱和熟石灰都是碱;⑦烟和豆浆都是胶体,正确的是 ( )
A.①③④⑦ B.①②③④ C.①②⑤⑥ D.③⑤⑥⑦
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.味觉上有酸味的食物称为酸性食物
B.生石灰可防止食物受潮,铁粉可防止食物氧化变质
C.油脂、淀粉、蛋白质和维生素等均为高分子化合物
D.食品添加剂苯甲酸钠是苯的一种同系物所对应的钠盐
难度: 简单查看答案及解析
-
下列叙述中,正确的是 ( )
A.1mol过氧化钠中所含阴离子数为2×6.02×1023
B.14g乙烯和丙烯的混合物中含有的碳原子数目为6.02×1023
C.28gC16O与28gC18O中含有的质子数均为14×6.02×1023
D.标准状况下,22.4L 氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
难度: 简单查看答案及解析
-
下列6种试剂:①烧碱溶液;②金属钠;③浓硝酸;④葡萄糖溶液;⑤氯化铝溶液;⑥氨水,可以直接盛放在带磨口玻璃塞的无色试剂瓶中的是 ( )
A.①和③ B.②和④ C.③和⑥ D.④和⑤
难度: 简单查看答案及解析
-
某化合物由碳、氢、氧三种元素组成,红外光谱图显示有三种共价键的振动吸收,核磁共振氢谱图显示有三个峰,峰面积比为6:1:1,则该有机物的结构简式是( )
A.C2H5OCH3 B.CH3CH(OH)CH3
C.CH3CH2CH2OH D.CH3CH2CHO
难度: 简单查看答案及解析
-
根据表中信息,下列叙述正确的是 ( )
短周期元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.氢化物的热稳定性:H2T<H2R
B.单质与稀盐酸反应的速率:L<Q
C.M 与T 形成的化合物既能与强酸反应,又能与强碱反应且受热能分解
D.离子半径:R2-<L2+
难度: 简单查看答案及解析
-
已知A、B为单质,C为化合物
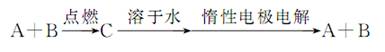
能实现转化的是 ( )
①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④
难度: 简单查看答案及解析
-
工业上冶炼钼的化学原理为
①2MoS2+7O2
2MoO3+4SO2
②MoO3+2NH3·H2O====(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl
④H2MoO4
MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。下列说法正确的是 ( )
A.MoS2高温煅烧反应中MoS2既是氧化剂又是还原剂
B.MoO3是金属氧化物,属于碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等物质的量的MoO3 得到Mo,所消耗三种还原剂的物质的量之比为3:3:2
难度: 简单查看答案及解析
-
阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为

下列说法正确的是 ( )
A.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与Na2CO3、NaHCO3、NaOH溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
难度: 简单查看答案及解析
-
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应式为:2H2+O2=====2H2O,下列有关说法正确的是 ( )
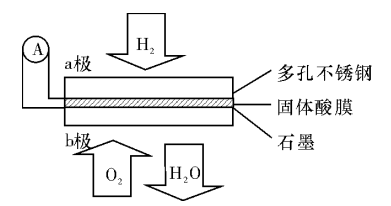
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-====4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
难度: 简单查看答案及解析
-
如图所示为一恒压容器。在恒定温度下,将1molN2和3molH2混合后由A 口快速充入封闭容器,反应N2+3H2
2NH3在t1 时刻达到平衡,t2时刻再从A口快速充入一定量NH3,封闭A,t3重新达平衡至t4。在0→t4 时间内混合气中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是 ( )
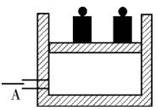
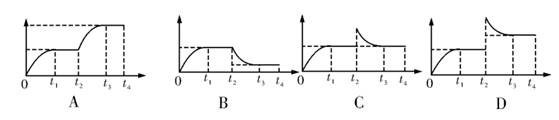
难度: 简单查看答案及解析
-
25°C时,下列关于分别由等体积0.1mol/L的2种溶液混合而成的溶液的说法中,不正确的是 ( )
A.Ba(OH)2溶液与Na2SO4溶液:pH=13
B.醋酸与CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.Na2CO3溶液与NaOH溶液:c(Na+)>c(CO2-3)>c(OH-)>c(H+)
D.Na2CO3溶液与NaHCO3溶液:2c(Na+)=3c(CO2-3)+3c(HCO-3)+3c(H2CO3)
难度: 简单查看答案及解析