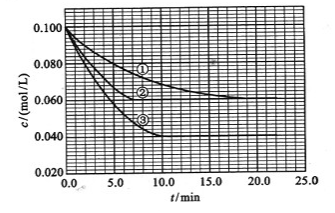
-
下列说法正确的是( )
A.通常情况下,氮气的性质不活泼是因为氮元素的非金属性很弱的缘故
B.氮气是非极性分子,氨气是极性分子
C.白磷和红磷互为同素异形体,它们之间的相互转化为物理变化
D.五氧化二磷是磷酸的酸酐,二氧化氮是硝酸的酸酐
难度: 简单查看答案及解析
-
类比是一种常见的学习方法,下列类比推断正确的是( )
A.铁遇浓硝酸发生钝化,铜遇浓硝酸也发生钝化;
B.稀硫酸遇蓝色石蕊试纸变红色,浓硫酸遇蓝色石蕊试纸也变红色;
C.CH4是极性键构成的非极性分子,CCl4也是极性键构成的非极性分子;
D.铁与稀硝酸作用产生NO,铁与浓硝酸作用也产生NO;
难度: 简单查看答案及解析
-
NO分子在人体内有独特功能,Murad等三位教授的研究荣获了1998年诺贝尔医学及生理学奖,关于NO的下列叙述不正确的是( )
A.NO可以是某些含低价N物质氧化的产物;
B.NO属于一种大气污染物,易结合血红蛋白使人中毒;
C.NO是汽车尾气废气排放产生的污染之一;
D.NO是红棕色气体;
难度: 简单查看答案及解析
-
下列各组气体通常状态下能稳定共存,并均能用浓硫酸干燥的是( )
A、NH3,O2,HCl B、NO,NO2,O2 C、N2,H2,HCl D、H2,N2,NH3
难度: 简单查看答案及解析
-
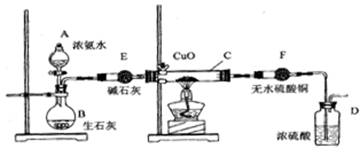
下列装置或操作能达到实验目的的是( )
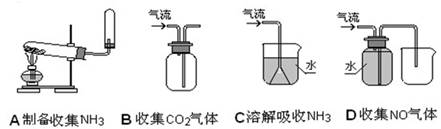
难度: 简单查看答案及解析
-
下列离子在溶液中能大量共存的是( )
A.NH4+、SO42—、NO3—、H+ B.I-、NO3—、H+、K+
C.NH4+、Cl-、OH-、NO3— D.Na+、H+、SO32—、SO42—
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )
A.碳酸钙溶解于稀硝酸中:CO32-+2H+=CO2↑+H2O
B.向(NH4)2SO4溶液中滴加Ba(OH)2溶液:Ba2++SO42-==BaSO4↓
C.铜与稀硝酸反应:3Cu+2NO3—+8H+==3Cu2++2NO↑+4H2O
D.盐酸滴入氨水中:H++OH-=H2O
难度: 简单查看答案及解析
-
在8NH3+3Cl2=6NH4Cl+N2反应中,若有2mol N2生成,发生氧化反应的物质的量
A.16 mol NH3 B.8 mol NH3 C.4 mol NH3 D.3 mol NH3
难度: 简单查看答案及解析
-
在1L1mol/L的氨水中
A.含有1molNH3 B.含NH3和NH4+之和为1mol
C.含NH3·H2O1mol D.含NH3、NH4+、NH3·H2O共1mol
难度: 简单查看答案及解析
-
在容积为1L的干燥烧瓶中,用向下排空气法充入NH3后,测得烧瓶中的气体对氢气的相对密度为9.7。若将此气体进行喷泉实验,当喷泉停止后进入烧瓶中溶液的体积应为
A.
L B.
L C.
L D.
L
难度: 简单查看答案及解析
-
某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入2.56克Cu粉,待充分反应后,溶液中Cu2+物质的量浓度为
A.0.15mol/L B.0.3mol/L C.0.225mol/L D.无法计算
难度: 简单查看答案及解析
-
可逆反应2SO2(g)+O2(g)
2SO3(g),在体积为2L的密闭容器中进行,如果SO2在某时刻的物质的量为4mol,2min后变为3.6mol,则用O2的浓度变化表示这段时间的反应速率为( )mol·(L·min) -1
A.0.05 B. 0.2 C. 0.1 D. 0.4
难度: 简单查看答案及解析
-
可逆反应A(g)+3B(g)
2C(g)+2D(g),在不同条件下的反应速率如下,其中反应速率最快的是
A.vA=0.15mol/ (L·min) B.vB =0.6mol/ ( L·min)
C.vc=0.04mol/ ( L·s) D.vD=0.01mol/ (L·s)
难度: 简单查看答案及解析
-
改变以下反应的条件,能提高反应物活化分子百分数的是 ①温度 ②浓度 ③压强 ④正催化剂( )
A.①④ B.②③ C.①② D.③④
难度: 简单查看答案及解析
-
对可逆反应:A(g) + B(s)
C(s) + D(g);(正反应吸热)。下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:( )
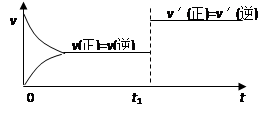
①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件是
A.②③ B.①② C.③④ D.④⑤
难度: 简单查看答案及解析
-
在一定条件下,可逆反应 A(g)+ B(g)
2C(g)达到平衡的标志是 ( )
①A、B、C的分子数比为1∶1∶2
②A、B、C的浓度不再产生变化
③ 单位时间生成n摩尔 A,同时增加2n摩尔 C
④平衡体系中的压强不再发生变化
A.①② B.①④ C.②③ D.②④
难度: 简单查看答案及解析
-
对于反应2CO(g)+ O2(g)
2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡正向移动的是( )
A.恒温恒容通入He B.再通入少量CO2 C.温度升高 D.加压
难度: 简单查看答案及解析
-
在恒温恒容条件下,有反应2A(g)+2B(g)
C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1 Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是( )
A.达到平衡时,I途径的反应速率和Ⅱ途径的反应速率相同
B.达平衡时,体系内混合气体的平均密度相同
C.I、Ⅱ两途径达到平衡时,体系内混合气体的百分组成相同
D.I、Ⅱ两途径达到平衡时,体系内混合气体的平均相对分子质量不同
难度: 简单查看答案及解析
-
下列反应:2HBr(g)
Br2(g)+H2(g)在密闭容器中进行,将密闭容器的体积缩小至原来的一半 ,下列说法正确的是( )
A.化学反应速率不变,平衡不移动 B.化学反应速率加快,平衡不移动
C.平衡向右移动,气体颜色加深 D.平衡不移动,气体颜色不变
难度: 简单查看答案及解析
-
反应:A(g)+3B(g)
2C(g)(正反应为放热反应)达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
难度: 简单查看答案及解析
-
以下事实不能用勒夏特列原理解释的是( )
A.增大压强,有利于二氧化硫和氧气反应生成三氧化硫
B.工业制取硫酸和合成氨反应都要使用催化剂
C.合成氨工业生产中,把合成塔中的氨气不断抽出
D.实验室常用排饱和食盐水的方法收集氯气
难度: 简单查看答案及解析
-
一氧化氮和一氧化碳都是汽车尾气里的有害物质,它们能缓慢地发生如下反应:2NO(g)+2CO(g)
N2(g)+2CO2(g)(正反应为放热反应)。现利用此反应,拟设计一种环保装置以减轻汽车尾气对大气的污染。下列设计方案可以提高尾气处理效果的是
A.不断向装置中鼓入空气 B.提高反应装置的温度
C.降低反应装置的压强 D. 在反应装置中装入碱石灰
难度: 简单查看答案及解析
-
下图表示可逆反应mA(g)+nB(g)
pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是( )

A.吸热反应,m+n<p B.吸热反应,m+n>p
C.放热反应,m+n<p D.放热反应,m+n>p
难度: 简单查看答案及解析