-
1862年一位英国化学家根据O2和Xe的第一电离能非常接近,利用类比思想合成第一种稀有气体化合物,大大推动了对稀有气体的研究,为开拓稀有气体化学作出了历史性的贡献。该化学家为( )
A.巴尔末 B.巴特列 C.洪特 D.范德华
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.电子云就是电子运动的形态
B.焰色反应产生的是发射光谱
C.铜原子处于基态时的核外电子排布式为3d104s1
D.核外电子运动状态可以用牛顿运动定律来描述,也可以用统计方法来描述
难度: 简单查看答案及解析
-
在多电子原子中,轨道能量是由以下哪些因素决定( )
①电子层②原子轨道类型(电子亚层)③空间伸展方向④自旋状态
A.①② B.①④ C.②③ D.③④
难度: 简单查看答案及解析
-
下列表示方法正确的是( )
A.铜的原子结构示意图:
B.S2- 核外电子排布式:[Ne] 2s23p6
C.O原子处于基态的轨道表示式:
D.用电子式表示MgCl2的形成:

难度: 简单查看答案及解析
-
下列化学式能真实表示物质分子组成的是( )
A.NaOH B.SO2 C.P(白磷) D.SiO2
难度: 简单查看答案及解析
-
下列有关化学键与晶体结构的说法正确的是
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
难度: 简单查看答案及解析
-
下列关于d轨道的说法错误的是( )
A.M层才开始出现d轨道 B.d轨道最早出现在第4周期元素
C.电子排布时,3d轨道能量高于4s轨道 D.d轨道有10种空间伸展方向
难度: 简单查看答案及解析
-
如图是两个氢原子相互接近时的能量变化图,则有关该图的说法正确的是( )

A.y代表两原子之间的核间距
B.x代表体系具有的能量
C.a代表核外电子自旋相反的两个氢原子能量变化
D.A点时表示两原子间形成了稳定的共价键
难度: 简单查看答案及解析
-
下列有关晶体的说法中正确的是
A.氯化钾溶于水时离子键未被破坏 B.原子晶体中共价键越强,熔点越高
C.冰融化时分子中共价键发生断裂 D.范德华力越大,分子越稳定
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
难度: 简单查看答案及解析
-
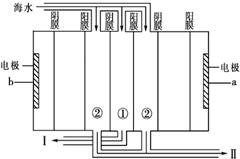
下列说法中错误的是( )
A.检验天然水是否为硬水最简单的方法是用肥皂水检验
B.冷冻法进行海水淡化是利用海水蒸发吸热使海水冷却形成冰晶,这种方法能耗小
C.反渗透法进行海水淡化能大量快速生成淡水,其技术关键在于寻找理想的渗透膜
D.处理污水主要是生物化学方法,这种方法的关键是培养好活性污泥中的微生物,并提高处理过程的曝气效率
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.第一电离能越小的元素其单质金属活泼性一定越大
B.电负性越小的元素金属性一定越强
C.元素电负性相差小于1.7的元素之间形成的化学键一定为共价键
D.制造光电材料的元素主要从IA族中寻找其主要原因是IA的第一电离能比较低
难度: 简单查看答案及解析
-
下列有关作用力的说法正确的是( )
A.金属键、离子键、分子间作用力都没有方向性和饱和性
B.键能、金属的原子化热、晶格能分别可以衡量氢键、金属键、离子键的强弱
C.离子键、金属键、氢键、范德华力本质上都是静电作用
D.乙酸、丙醇、丙酮的沸点都比丁烷高是因为前三者分子间都存在氢键
难度: 简单查看答案及解析
-
下面有关晶体的叙述中,错误的是( )
A.金刚石网状结构中,碳原子和共价键的个数比为1:2
B.氯化钠晶体中,每个Na+周围距离相等的Cl-肯定为6个
C.氯化铯晶体中,每个Cs+周围紧邻6个Cs+
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
难度: 简单查看答案及解析
-
有关CH2=CH-C≡N分子的说法正确的是( )
A.3个
键,2个π键 B.5个
键,3个π键
C.6个
键,2个π键 D.6个
键,3个π键
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.对羟基苯甲酸的沸点比邻羟基苯甲酸高,冰中既存在范德华力,又存在氢键
B.简单立方是非密置层三维堆积形成的,面心立方是由密置层三维堆积形成的
C.所有共价键都有方向性,形成氢键的三个相关原子可以不在直线上
D.金属晶体的导电、导热性都与自由电子有关,离子晶体在一定条件下可以导电
难度: 简单查看答案及解析
-
最近,美国LawreceLiremore国家实验室(LLNL)的V.Lota.C.S.Yoo和Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是( )
A.CO2的原子晶体中存在范德华力,每1molCO2原子晶体中含有2NA
键
B.在一定条件下,CO2原子晶体转化为分子晶体CO2是物理变化
C.熔点:金刚石>原子晶体CO2>SiO2
D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合
难度: 简单查看答案及解析
-
下列方程式正确的是( )
A.用氯胺处理自来水:NH2Cl+H2O
NH2OH+HCl
B.在含有Mg2+、HCO3-的自来水中加入过量的澄清石灰水:
Ca2+ +Mg2+ +2OH- +2HCO3-=CaCO3↓+MgCO3↓+2H2O
C.长时间煮沸含Mg2+、HCO3-的自来水:Mg2+ +2HCO3-
Mg(OH)2↓+2CO2↑
D.Na2FeO4既是混凝剂、又可作消毒剂,作混凝剂的作用原理为:
Fe3+ +3H2O=Fe(OH)3(胶体)+3H+
难度: 简单查看答案及解析
-
表中原子化热、晶格能、键能的单位都是kJ·mol-1
金属
金属原子化热
离子化合物
晶格能
共价键
键能
Na
108.4
NaCl
786
Cl-Cl
243
Mg
146.4
NaBr
747
Si-Si
176
Al
326.4
MgO
3791
Si-Cl
360
则下列说法正确的是( )
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
难度: 简单查看答案及解析
-
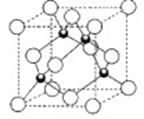
某化学式为AB的离子晶体,已.5r(A2+)=4r(B2-)(各类离子晶体与
关系如下图所示),经测定其密度为
g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
r+/r-
配位数
实例
0.225~0.414
4
ZnS
0.414~0.732
6
NaCl
0.732~1.0
8
CsCl
>1.0
12
CsF
A.该晶体结构与ZnS晶体相似
B.该晶体每个晶胞中有2个A2+和B2-
C.该晶体晶胞的边长为
cm
D.A2+离子紧邻的B2-构成的空间结构为立方体
难度: 简单查看答案及解析