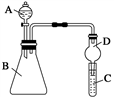
-
元素性质呈周期性变化的决定因素是( )
A. 元素原子半径大小呈周期性变化
B. 元素的相对原子质量依次递增
C. 元素原子核外电子排布呈周期性变化
D. 元素的最高正化合价呈周期性变化
难度: 中等查看答案及解析
-
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是( )
A. a=b+m+n B. a=b-m+n C. a=b+m-n D. a=b-m-n
难度: 简单查看答案及解析
-
下列各组物质中,化学键类型相同的是( )
A.CaF2和CsCl B.NaOH和H2SO4 C.NaCl和HNO3 D.CCl4和Na2S
难度: 中等查看答案及解析
-
提高能源的利用率已成为国际能源研究的热点课题。下列相关措施使用不当的是( )
A.使燃料充分燃烧
B.加大能源开采力度
C.加强能源利用的科技投入
D.合理使用能源
难度: 简单查看答案及解析
-
X、Y-、Z2+三种微粒的电子层结构相同,则一定不能再相等的是( )
A. 中子数 B. 质量数
C. 电子数 D. 核电荷数
难度: 简单查看答案及解析
-
下列装置能形成原电池且灵敏电流计指针发生偏转的是
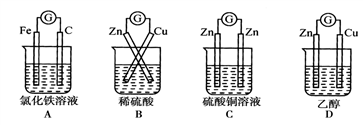
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. 硫化氢分子的电子式:
B.S2﹣的结构示意图:
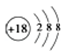
C.HClO的结构式:H-O-Cl D.NH4Cl的电子式:
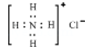
难度: 简单查看答案及解析
-
关于原子结构、元素性质的说法正确的是
A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.在化学反应中,原子首先失去的电子能量最低
D.在元素周期表中,各主族元素的最高化合价与其族序数相等
难度: 中等查看答案及解析
-
下列用电子式表示的形成过程正确的是
A、
B、
C、
D、
难度: 简单查看答案及解析
-
下列实验设计不能达到实验目的的是
选项
实验设计
实验目的
A
分别取大小相近的钠粒、钾粒投入水中,观察反应的剧烈程度
比较钠、钾元素的金属性强弱
B
将两块相同的铝片放入不同浓度的稀盐酸中,观察产生气泡的速率
验证H+的浓度是影响反应速率的唯一因素
C
将少量溴水加入碘化钾溶液中,再加入CCl4,振荡,静置,观察CCl4层颜色
比较溴单质和碘单质的氧化性性强弱
D
向硅酸钠溶液中加入稀硫酸,观察是否有沉淀生成
比较硫元素和硅元素的非金属性强弱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是
A. Y的阴离子Y-的还原性强于X的阴离子X-
B. X的氢化物的水溶液的酸性比Y的氢化物的水溶液的酸性强
C. X的单质X2能将Y的阴离子Y-氧化成Y2
D. X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价
难度: 中等查看答案及解析
-
下列过程只需要克服分子间作用力的是
A.HCl气体溶于水 B.碘单质升华
C.氯化镁受热熔化 D.二氧化硅受热熔化
难度: 中等查看答案及解析
-
在其它条件不变时,10℃时以某物质表示的反应速率为3 mol•(L· s )-1 ,已知温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为
A.48 mol•(L· s )-1 B.36 mol•(L· s )-1
C.24 mol•(L· s )-1 D.12 mol•(L· s )-1
难度: 中等查看答案及解析
-
下列说法正确的是
A.物质发生化学反应都伴随着能量变化 B.吸热反应一定需要加热才能发生
C.凡是放热反应的发生均无需加热 D.伴有能量变化的物质变化都是化学变化
难度: 中等查看答案及解析
-
电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:Zn + 2OH- -2e-==ZnO + H2O Ag2O +H2O + 2e-==2Ag +2 OH-,下列判断正确的是
A. 锌为正极,Ag2O为负极
B. 锌为负极,Ag2O为正极
C. 原电池工作时,溶液中OH-- 移向正极
D. 原电池工作时,溶液中电子由负极流向正极
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. H2O在高温下难分解,H2S在300℃即分解,说明氧的非金属性比硫强
B. I-的还原性比Br-强,由此可推断溴的非金属性比碘强
C. H2CO3的酸性比HClO的酸性强,说明碳的非金属性比氯强
D. 已知反应:2NH3+3Cl2===N2+6HCl,由此可推断非金属性氯强于氮
难度: 中等查看答案及解析