-
下列说法不正确的是
A.含铅汽油、含磷洗涤剂的使用均可对环境造成危害
B.棉花、木材及草类的纤维都是天然纤维
C.氮化硅陶瓷、光导纤维均属于新型无机非金属材料
D.煤、石油、天然气均属于可再生的化石燃料
难度: 简单查看答案及解析
-
在pH=1的无色溶液中, 下列离子能大量共存的是
A.NH4+、Ba2+、NO3- 、CO32- B.Fe2+、OH-、SO42-、MnO4-
C.K+、Mg2+、NO3-、SO42- D.Na+、Fe 3+、Cl-、AlO2-
难度: 中等查看答案及解析
-
下列有机物的结构简式书写正确的是
A.3-甲基丁醛 (CH3)2CHCH2COH
B.TNT

C.硬脂酸甘油酯
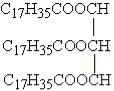
D.乙酸甲酯 CH3OOCCH3
难度: 简单查看答案及解析
-
在25 ℃时,将pH=11的NaOH溶液a mL 与pH=1的H2SO4溶液b mL混合, 当恰好完全中和时, a 与b的比值为
A.1000:1 B.100:1 C.50:1 D.10:1
难度: 中等查看答案及解析
-
运用元素周期律分析下面的推断。其中错误的是
A.已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
B.已知As是第四周期、VA族的元素,故As H3的酸性比NH3的稳定性强
C.已知Cs的原子半径比Na的大,故Cs与水反应比Na与水反应更剧烈
D.已知Cl的核电荷数比Al的核电荷数大,故 Cl的原子半径比Al的原子半径小
难度: 中等查看答案及解析
-
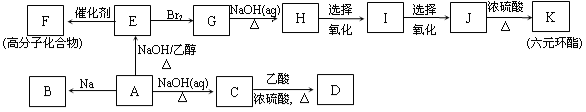
单质Ti的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属Ti。由TiO2制金属Ti的反应为:
① TiO2+2C+2Cl2
TiCl4+2CO ② TiCl4+2Mg
2MgCl2+Ti
则下列叙述正确的是
A.由反应①可知,Cl2是氧化剂,TiCl4是氧化产物
B.由反应①可知,可用CO在高温下把TiO2还原成Ti
C.由反应②可知,若有24 g Mg参加反应,就可生成1 mol Ti
D.由反应②可知,金属Mg的还原性比金属Ti的还原性强
难度: 中等查看答案及解析
-
一定温度下,在一个体积可变的密闭容器中加入2 mol N2和2 mol H2,建立如下平衡:N2(g)+3H2(g)
2NH3(g)相同条件下,若向容器中再通入1 mol N2和1 mol H2,又达到平衡。则下列说法正确的是
A.NH3的百分含量不变 B.N2的体积分数增大
C.H2的转化率增大 D.NH3的百分含量增大
难度: 困难查看答案及解析
-
某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH溶液。该电池的总反应是:Zn+Ag2O=2Ag+ZnO ,下列说法正确的是:
A.Zn极为负极,其电极反应为:Zn+2OH――2e-=ZnO+H2O
B.Ag2O极为负极,其电极反应为:Ag2O+H2O―2e-=2Ag+2OH―
C.电池放电过程中,负极周围溶液的pH不断增大
D.该电池用完后,可作为普通垃圾处理,因为它不会造成环境污染
难度: 中等查看答案及解析