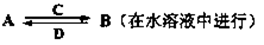-
化学工业是国民经济的支柱产业,下列生产过程中不涉及化学变化的是
A.化工厂用氯气制漂白粉 B.冶炼厂用氧化铝生产铝
C.硝酸厂用氨制硝酸 D.炼油厂分馏法生产汽油
难度: 中等查看答案及解析
-
下列物质分类正确的是
A.SO2、SiO2、CO2均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳、氨气均为电解质
D.福尔马林、水玻璃、氢氟酸、小苏打均为纯净物
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA
B.常温常压下,18g H2O含有的原子总数为3NA
C.1.0L的0.1 mol·L-1Na2S溶液中含有的S2-离子数为0.1NA
D.2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等
难度: 困难查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH–= CO32-+ H2O
B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-= NH3↑+H2O
C.将过量二氧化硫气体入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
D.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓
难度: 困难查看答案及解析
-
在水溶液中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32- B.K+、NH4+、OH-、SO42
C.Na+、Ba2+、Cl—、NO3— D.H+、Na+、Fe2+、MnO4-
难度: 中等查看答案及解析
-
下列金属防腐的措施中,属于使用电化学保护法的是
A.在铁中加入铬、镍等制成不锈钢 B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜 D.地下钢管连接镁块
难度: 中等查看答案及解析
-
化学无处不在,与化学有关的说法不正确的是
A.工业制碱用食盐和二氧化碳、氨气反应生产碳酸氢钠应用了物质溶解度的差异
B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
C.黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成
D.碘是人体必需微量元素,所以要多吃富含高碘酸的食物
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列说法正确的是
W
X
Y
Z
A.四种元素中最简单氢化物稳定性最强的是Y
B.Z元素最高价氧化物对应水化物的酸性一定强于Y
C.X与Y元素的化合价完全相同
D.Z元素单质在化学反应中只表现氧化性
难度: 困难查看答案及解析
-
下列有关元素的性质及其递变规律正确的是( )
A.IA族与ⅦA族元素间形成的化合物都是离子化合物
B.第三周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,其单质的氧化性越强
D.同周期金属元素的化合价越高,其原子失电子能力越强
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀锌铁制品镀层受损后,铁制品比受损前更容易生锈
C.生铁中含有碳,抗腐蚀能力比纯铁强
D.Zn具有还原性和导电性,可用作碱性锌锰干电池的负极材料
难度: 中等查看答案及解析
-
以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
A.电能全部转化为化学能
B.粗铜接电源正极,发生还原反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Pt、Au等金属
难度: 中等查看答案及解析
-
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O △H﹤0
难度: 中等查看答案及解析
-
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72—+6Fe2+ +14H+
2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是
A.电解过程中溶液pH不会变化
B.阳极反应为Fe-2e-
Fe2+
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原
难度: 中等查看答案及解析
-
下列说法不合理的是
A.FeCl2、Na2O2、NaHCO3均可通过化合反应生成
B.在稀硫酸中加入铜粉,铜粉不溶解,若加入KNO3固体,铜粉溶解
C.用渗析的方法可除去Fe(OH)3胶体中混有的Cl-
D.氧化铝具有高熔点,用氧化铝制作的坩埚可用来蒸发浓缩烧碱溶液
难度: 中等查看答案及解析
-
下列说法正确的是
A.在2H2O2 =2H2O +O2反应中,每生成32g 氧气,则转移2NA个电子
B.钠、铁的金属性均比铜的强,说明两者均可以从硫酸铜溶液中置换出单质铜
C.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将氨气通入酚酞溶液中,变色后加热不能恢复原色
难度: 中等查看答案及解析
-
下列有关实验操作正确的是
A.用过滤法分离氢氧化铁胶体和三氯化铁溶液的混合物
B.用容量瓶配制溶液,定容后摇匀液面下降,再加蒸馏水至刻度线
C.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大
D.将金属钠投入到足量CuSO4溶液中,静置后溶液质量增加
难度: 中等查看答案及解析
-
下列实验的现象与对应结论均正确的是
选项 操作 现象 结论
A 将浓硫酸滴到蔗糖表面 固体变黑膨胀 浓硫酸有吸水性和强氧化性
B 常温下将Al片放入浓硝酸中 无明显变化 Al与浓硝酸不反应
C 将一小块Na放入无水乙醇中 产生气泡 Na能置换出醇羟基中的氢
D 将水蒸气通过灼热的铁粉 粉末变红 铁与水在高温下发生反应
难度: 中等查看答案及解析
-
将过量的CO2分别通入①CaC12溶液;②Na2SiO3溶液;③Ca(C1O)2溶液;④饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是
A.①②③④ B.②④ C.①②③ D.②③
难度: 中等查看答案及解析